(2012?丹东模拟)能源短缺是人类面临的重大问题.甲醇是一种可再生能源.具有广泛的开发和应用前景.因此甲醇被称为21世纪的新型燃料.
(1)已知在常温常压下:
①2CH
3OH(l)+3O
2(g)═2CO
2(g)+4H
2O(g)△H=
_1275.6kJ?mol
-1②H
2O(l)═H
2O(g)△H=+44.0kJ.mol
-1写出表示甲醇燃烧热的热化学方程式:
CH
3OH(g)+
O
2(g)=CO
2(g)+2H
2O(l)△H=-725.8kJ/mol
CH
3OH(g)+
O
2(g)=CO
2(g)+2H
2O(l)△H=-725.8kJ/mol
.
(2)工业上一般采用下列两种反应合成甲醇:
反应A:CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g)△H
1反应B:CO(g)+2H
2(g)?CH
3OH(g)△H
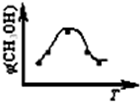
2取五份等体积CO
2和H
2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH
3OH) 与反应温度T的关系曲线如图所示,则上述CO
2转化为甲醇的反应的△H
1<
<
0(填“>”、“<”或“=”).
②对于反应A,若容器容积不变,下列措施可增加甲醇产率的是
BD
BD
.
A.升高温度 B.增加CO
2的量
C.充入He,使体系总压强增大 D.按原比例再充入CO
2和H
2③某温度下,将4mol CO和12mol H
2,充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.5mol?L
-1,则该温度下该反应的平衡常数为
0.33
0.33
.
④.某种甲醇-空气燃料电池是采用铂作为电极,稀硫酸作电解质溶液.其工作时负极的电极反应式可表示为
CH3OH-6e-+H2O=6H++CO2↑
CH3OH-6e-+H2O=6H++CO2↑
(3)对燃煤烟气中的SO
2、NO
2设物质的量之比为1:1,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥,则该反应的化学方程式为
12NH3+3O2+4SO2+4NO2+6H2O=4(NH4)2SO4+4NH4NO3
12NH3+3O2+4SO2+4NO2+6H2O=4(NH4)2SO4+4NH4NO3
.
(4)在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na
+)+c(H
+)
<
<
c(NO
3-)+c(OH
-)(填写“>”“=”或“<”)

 (2012?丹东模拟)能源短缺是人类面临的重大问题.甲醇是一种可再生能源.具有广泛的开发和应用前景.因此甲醇被称为21世纪的新型燃料.
(2012?丹东模拟)能源短缺是人类面临的重大问题.甲醇是一种可再生能源.具有广泛的开发和应用前景.因此甲醇被称为21世纪的新型燃料.

 阅读快车系列答案
阅读快车系列答案