
| A. | NaHCO3在水溶液中水解:HCO3-+H2O?H3O++CO32- | |
| B. | 电解饱和食盐水:C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+Cl2↑+OH- | |
| C. | 氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e一=4OH- | |
| D. | FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- |
分析 A.碳酸氢钠溶液中碳酸氢根离子是弱酸阴离子溶液中水解是结合水电离出的氢离子,促进水电离平衡正向进行,选项中是碳酸氢根离子的电离方程式;
B.电解饱和食盐水溶液是氯离子在阳极失电子生成氯气,氢离子在阴极生成氢气,反应是氯化钠和水反应在通电条件下反应生成氢氧化钠、氯气和氢气;
C.燃料电池中发生的氧化还原反应,燃料在负极失电子发生氧化反应,氧气在正极得到电子发生还原反应,碱性环境中氧气得到电子生成氢氧根离子;
D.选项中离子方程式中不符合电荷守恒;
解答 解;A.NaHCO3在水溶液中水解:HCO3-+H2O?OH-+H2CO3,HCO3-+H2O?H3O++CO32- 是碳酸氢根离子的电离方程式,把氢离子写成了水合氢离子的形式,故A错误;
B.电解饱和食盐水溶液是氯离子在阳极失电子生成氯气,氢离子在阴极生成氢气,反应是氯化钠和水反应在通电条件下反应生成氢氧化钠、氯气和氢气,反应的离子方程式为:C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+Cl2↑+2OH-,故B错误;
C.氧气在正极得到电子发生还原反应,碱性环境中氧气得到电子生成氢氧根离子,电电极反应O2+2H2O+4e一=4OH-,故C正确;
D.FeCl2溶液中通入Cl2离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故D错误;
故选C.
点评 本题考查了离子方程式书写和正误判断,注意原电池中电极反应的书写方法,正误基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
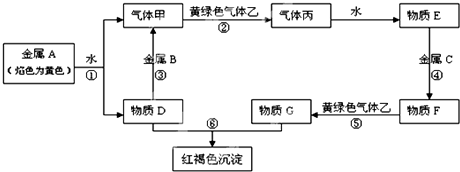
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同质量的N4、N5分子其原子数之比为5:4 | |
| B. | N5、N4与N2互为同素异形体 | |
| C. | N4、N5均属于新型的化合物 | |
| D. | N5的摩尔质量为70 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应的实质是电子转移 | B. | 氧化剂在反应中本身被还原 | ||
| C. | 氧化反应和还原反应同时进行 | D. | 氧化还原反应一定有单质参加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
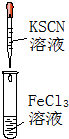 | 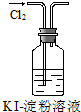 | 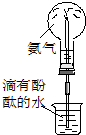 | 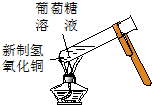 |
| ① | ② | ③ | ④ |
| A. | 实验①试管中混合溶液中出现红色沉淀 | |
| B. | 实验②中溶液变黄色 | |
| C. | 实验③中烧瓶内溶液变红色 | |
| D. | 实验④中出现黑色氧化铜固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
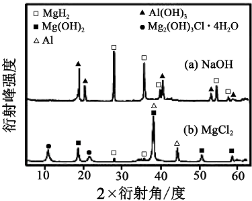
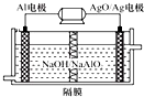
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com