
溶液电导率与溶液中各离子的总浓度有关,离子浓度越大,溶液电导率越大.现在向甲溶液中加入等浓度的乙溶液至恰好反应,混合溶液电导率与乙溶液体积的关系曲线如下所示,其中曲线错误的是( )
|
| A. |
| B. |
| C. |
| D. |
|
考点:
电解质溶液的导电性.
专题:
图示题;电离平衡与溶液的pH专题.
分析:
A、醋酸和氢氧化钠之间可以发生中和反应生成醋酸钠和水,对比醋酸和醋酸钠导电性大小即可;
B、硫酸和氢氧化钡之间可以发生中和反应生成硫酸钡和水,对比硫酸和硫酸钠导电性大小即可;
C、盐酸和氢氧化钠之间可以发生中和反应生成氯化钠和水,对比氢氧化钠和氯化钠导电性大小即可;
D、盐酸和氨水之间可以发生中和反应生成氯化铵和水,对比盐酸和氯化铵导电性大小即可.
解答:
解:A、向醋酸溶液中加入等浓度的氢氧化钠溶液至恰好反应,生成醋酸钠和水,醋酸钠的浓度最终是醋酸、氢氧化钠浓度的一半,所以混合溶液电导率与氢氧化钠溶液体积关系是先增大,后减小,故A错误;
B、硫酸和氢氧化钡之间可以发生中和反应生成硫酸钡和水,当恰好反应时,生成的硫酸钡和水的导电率几乎是零,故B正确;
C、盐酸和氢氧化钠之间可以发生中和反应生成氯化钠和水,生成氯化钠的总浓度和盐酸、氢氧化钠的总浓度和相等,故C正确;
D、盐酸和氨水之间可以发生中和反应生成氯化铵和水,氯化铵的浓度和小于盐酸和氨水的浓度之和,所以导电率逐渐减小,故D正确.
故选A.
点评:
本题考查学生电解质的导电性和离子浓度之间的关系,注意知识的迁移和应用是关键,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答
下列问题:

(1)该浓盐酸的物质的量浓度为___________mol/L。
(2)某学生欲用上述浓盐酸和蒸馏水配制250 mL物质的量浓度为
0.7 mol/L稀盐酸。
①该学生用量筒量取________ mL上述浓盐酸进行配制;
②所需的实验仪器有:①胶头滴管、②烧杯、③量筒、④玻璃棒,配制稀盐酸时,还缺少的仪器有 。
③下列操作导致所配制的稀盐酸的物质的量浓度偏低的是 (填字母)。
A、用量筒量取浓盐酸时俯视凹液面
B、未恢复到室温就将溶液注入容量瓶并进行定容
C、容量瓶用蒸馏水洗后未干燥
D、定容时仰视液面
E、未洗涤烧杯和玻璃棒
(3)若在标准状况下,将a L HCl气体溶于1 L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为  mol/L。
mol/L。
a. b.
b. c.
c.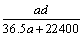 d.
d.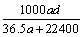
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的性质与氢键无关的是( )
|
| A. | 冰的密度比液态水的密度小 |
|
| B. | NH3易液化 |
|
| C. | NH3分子比PH3分子稳定 |
|
| D. | 在相同条件下,H2O的沸点比H2S的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验事实与平衡移动无关的是( )
|
| A. | 氯气难溶于饱和食盐水 |
|
| B. | 用加压的方法促进CO2在水中的溶解 |
|
| C. | FeCl3+3KSCN⇌Fe(SCN)3+KCl,向体系中加入KCl固体 |
|
| D. | 合成氨工业中,及时将氨气液化移出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
通过反应4NH3(g)+5O2(g) 4NO (g)+6H2O (g) 来制备NO,是硝酸合成中最为关键的一步,下列有关说法不正确的是( )
4NO (g)+6H2O (g) 来制备NO,是硝酸合成中最为关键的一步,下列有关说法不正确的是( )
|
| A. | 该反应的正反应是个熵增反应 |
|
| B. | 若起始条件n(NH3):n(O2)=4:5,无论平衡如何移动,NH3与O2平衡转化率一定相等 |
|
| C. | 减压使平衡正向移动,平衡常数将增大 |
|
| D. | 其他条件不变,使用更加高效的催化剂,达到平衡的时间缩短 |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①称取2gCuSO4•5H2O研细后倒入烧杯,加10mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用.
回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是 (填实验序号)
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较
用右图装置进行实验,实验时均以生成25mL气体为准,其它可能影响实验的因素均已忽略,相关数据如下:
| 实验序号 | KClO3质量 | 其它物质质量 | 待测数据 |
| ④ | 1.2g | 无其他物质 | |
| ⑤ | 1.2g | CuO 0.5g | |
| ⑥ | 1.2g | MnO2 0.5g |
回答下列问题:
(2)上述实验中的“待测数据”指 ;
(3)若要证明实验⑤中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞, ;
(4)为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a. ,b.CuO的化学性质有没有改变.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com