
下列物质的性质与氢键无关的是( )
|
| A. | 冰的密度比液态水的密度小 |
|
| B. | NH3易液化 |
|
| C. | NH3分子比PH3分子稳定 |
|
| D. | 在相同条件下,H2O的沸点比H2S的沸点高 |
考点:
氢键的存在对物质性质的影响.
专题:
化学键与晶体结构.
分析:
氢键的存在,影响到物质的某些性质.如熔点、沸点,溶解度,粘度,密度.
解答:
解:A、冰和水的密度不同主要是由于水分子间存在氢键,氢键在水液态是使一个水分子与4个水分子相连,而当水凝固时氢键会拉伸水分子 使水分子之间距离增大 体积也就增大了,密度也就小了,故A正确;
B、氨气内部存在氢键(分子间的一种作用力),使得其溶沸点升高,所以氨气容易液化,故B正确;
C、由于N的非金属性大于P,所以NH3分子比PH3分子稳定,故C错误;
D、组成和结构相似的分子,相对分子质量越大,其熔沸点越高,如果H2O不存在氢键,H2S沸点比H2O高,而事实上H2O的沸点比H2S高,是因为水里有氢键,故D正确;
故选:C.
点评:
本题需要注意的是氢键的存在,影响到物质的熔点、沸点,溶解度,粘度,密度.而非金属性强弱只影响分子的稳定性,不影响沸点.


科目:高中化学 来源: 题型:
根据反应式:(1)2Fe3++2I-=2Fe2++I2,(2)
Br2+2Fe2+=2Fe3++2Br-,判断下列离子的还原性由强到弱的顺序是( )
A.Br-、Fe2+、I- B.I-、Fe2+、Br- C.Br-、I-、Fe2+  D.Fe2+、I-、Br-
D.Fe2+、I-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
下述实验能达到预期目的的是( )
| 编号 | 实验内容 | 实验目的 |
| A | 将SO2通入酸性KMnO4溶液中 | 证明SO2具有漂白性 |
| B | Cl2能使湿润的红色布条褪色 | 证明Cl2具有漂白性 |
| C | 蓝矾固体放在浓硫酸中充分振荡,固体变为白色 | 证明浓硫酸具有吸水性 |
| D | 向某待测溶液中,加入BaCl2溶液,产生白色沉淀,然后再继续加入稀盐酸,沉 | 证明待测溶液中含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列组合中,属于含有极性键的非极性分子的是( )
|
| A. | C2H4、C2H2、CO2 | B. | CH4、CHCl3、CO2 |
|
| C. | Cl2、H2、N2 | D. | NH3、H2O、SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
通常把原子总数和价电子总数相同的分子或离子称为等电子体.人们发现等电子体的空间结构相同,则下列有关说法中正确的是( )
|
| A. | CH4和NH4+是等电子体,键角均为60° |
|
| B. | B3N3H6和苯是等电子体,1molB3N3H6和苯均有6mol非极性键 |
|
| C. | NH3和PCl3是等电子体,均为三角锥形结构 |
|
| D. | BF3和CO32﹣是等电子体,均为平面正三角形结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧时放出大量的热量.Al2H6球棍模型如图.下列说法肯定错误的是( )
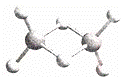
|
| A. | Al2H6在固态时所形成的晶体是分子晶体 |
|
| B. | 氢铝化合物可能成为未来的储氢材料和火箭燃料 |
|
| C. | Al2H6在空气中完全燃烧,产物为氧化铝和水 |
|
| D. | Al2H6中含有离子键和极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
溶液电导率与溶液中各离子的总浓度有关,离子浓度越大,溶液电导率越大.现在向甲溶液中加入等浓度的乙溶液至恰好反应,混合溶液电导率与乙溶液体积的关系曲线如下所示,其中曲线错误的是( )
|
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
关于氢键,下列说法正确的是( )
|
| A. | 每一个水分子内含有两个氢键 |
|
| B. | 冰、水和水蒸气中都存在氢键 |
|
| C. | DNA中的碱基互补配对是通过氢键来实现的 |
|
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com