
�����и��仯�У�EΪ��ɫ��ζ��Һ�壨�����£���FΪ����ɫ��ĩ��GΪ��������ɫ���壨��Ӧ��������ʡ�ԣ���
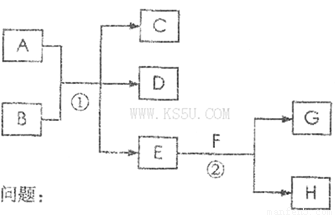
�ش��������⣺
��1���ڷ�Ӧ���У�ÿ����2.24L����G����״����ʱ���÷�Ӧת�Ƶ��ӵ����ʵ�����___________mol��
��2������Ӧ���ڼ��������½��У�����A�ͻ�����B�����ʵ���֮��Ϊ1��2������Ӧ����C��D�����־���ʹ�����ʯ��ˮ����ǵ���ɫ���壬��Ӧ�ٵĻ�ѧ����ʽ��___________________________________________��
��3������Ӧ������Һ�н��У�A��һԪǿ�B��һ����ʽ�Σ�D��һ��ʹʪ���ɫʯ����ֽ���������壬��B������������ʹƷ����Һ��ɫ�����塣�ڼ��������£���A����ʱ����Ӧ�ٵ����ӷ���ʽ��_________________________________________��
��1��0.2 molL��1�֣�
��2��2H2SO4(Ũ)+C 2SO2��+CO2��+2H2O��2�֣�
2SO2��+CO2��+2H2O��2�֣�
��3��HSO3-+NH4++2OH-=NH3��+SO32-+2H2O��2�֣�
��������
�����������������Ϣ��EΪ��ɫ��ζ��Һ�壨�����£���FΪ����ɫ��ĩ��GΪ��������ɫ���塱����֪EΪˮ��FΪ�������ƣ�GΪ������2Na2O2+2H2O=4NaOH+O2��. ÿ����2.24L����G����״����ʱ��ת�Ƶĵ�����2 mol. ��2��ͼ�з�Ӧ�ٵ���Ϣ֪��������A��C�ͻ�����B��Ũ���ᣬ���߷�Ӧ����CO2��SO2����ѧ����ʽ2H2SO4(Ũ)+C 2SO2��+CO2��+2H2O;
��3��ͼ����Ϣ��A��һԪǿ�B��һ����ʽ�Σ�D��һ��ʹʪ���ɫʯ����ֽ���������壬��B������������ʹƷ����Һ��ɫ�����塣A��NaOH��B��NH4HSO3.�����ʱ �ٵ����ӷ���ʽ��HSO3-+NH4++2OH-=NH3��+SO32-+2H2O
2SO2��+CO2��+2H2O;
��3��ͼ����Ϣ��A��һԪǿ�B��һ����ʽ�Σ�D��һ��ʹʪ���ɫʯ����ֽ���������壬��B������������ʹƷ����Һ��ɫ�����塣A��NaOH��B��NH4HSO3.�����ʱ �ٵ����ӷ���ʽ��HSO3-+NH4++2OH-=NH3��+SO32-+2H2O
���㣺��ͼ�ƶ���Ŀ��������Ϣ�ƶ����ʲ���д����ʽ����κ�Ũ���ἰSO2���ʵĿ��顣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����



| ||
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�����ʡ������ص�һ��ѧ����11��������ѧ�Ծ��������棩 ���ͣ������
�����и��仯�У�EΪ��ɫ��ζ��Һ�壨�����£���FΪ����ɫ��ĩ��GΪ��������ɫ���壨��Ӧ��������ʡ�ԣ����ش��������⣺

��1���ڷ�Ӧ���У�ÿ���� 2��24L ����G����״����ʱ���÷�Ӧת�Ƶ��ӵ����ʵ����� mol��
��2������Ӧ���ڼ��������½��У�����A�ͻ�����B�����ʵ���֮��Ϊ1:2������Ӧ����C��D�����־���ʹ�����ʯ��ˮ����ǵ���ɫ���壬��Ӧ�ٵĻ�ѧ����ʽ�� ��
��3������Ӧ������Һ�н��У�A��һԪǿ�B��һ����ʽ�Σ�D��һ ��ʹʪ���ɫʯ����ֽ���������壬��B������������ʹƷ����Һ��ɫ�����塣�ڼ��������£���A����ʱ����Ӧ�ٵ����ӷ���ʽ�� ��
( 4)�ɽ��ʯ(TiO2)��ȡ����Ti���漰���IJ���Ϊ��TiO2��TiCl4 Ti
Ti
��C(s) + O2(g) = CO2(g)�� ��H = ��393��5 kJ•mol-1
��2CO(g) + O2(g) = 2CO2(g)�� ��H = ��566 kJ•mol-1
��TiO2(s) + 2Cl2(g) = TiCl4(s) + O2(g)�� ��H = +141 kJ•mol-1
��TiO2(s) + 2Cl2(g) + 2C(s)= TiCl4(s) + 2CO(g) �ġ�H = _________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�����ʡ������ص�һ��ѧ����11��������ѧ�Ծ��������棩 ���ͣ������
�����и��仯�У�EΪ��ɫ��ζ��Һ�壨�����£���FΪ����ɫ��ĩ��GΪ��������ɫ���壨��Ӧ��������ʡ�ԣ����ش��������⣺

��1���ڷ�Ӧ���У�ÿ���� 2��24L ����G����״����ʱ���÷�Ӧת�Ƶ��ӵ����ʵ����� mol��
��2������Ӧ���ڼ��������½��У�����A�ͻ�����B�����ʵ���֮��Ϊ1:2������Ӧ����C��D�����־���ʹ�����ʯ��ˮ����ǵ���ɫ���壬��Ӧ�ٵĻ�ѧ����ʽ�� ��
��3������Ӧ������Һ�н��У�A��һԪǿ�B��һ����ʽ�Σ�D��һ ��ʹʪ���ɫʯ����ֽ���������壬��B������������ʹƷ����Һ��ɫ�����塣�ڼ��������£���A����ʱ����Ӧ�ٵ����ӷ���ʽ�� ��
( 4)�ɽ��ʯ(TiO2)��ȡ����Ti���漰���IJ���Ϊ��TiO2��TiCl4 Ti
Ti
��C(s) + O2(g) = CO2(g)�� ��H = ��393��5 kJ•mol-1
��2CO(g) + O2(g) = 2CO2(g)�� ��H = ��566 kJ•mol-1
��TiO2(s) + 2Cl2(g) = TiCl4(s) + O2(g)�� ��H = +141 kJ•mol-1
��TiO2(s) + 2Cl2(g) + 2C(s)= TiCl4(s) + 2CO(g) �ġ�H = _________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014���㽭ʡ�����а�У������ѧ�ڵڶ���������ѧ�Ծ��������棩 ���ͣ������
�����и��仯�У�EΪ��ɫ��ζ��Һ�壨�����£���FΪ����ɫ��ĩ��GΪ��������ɫ���壨��Ӧ��������ʡ�ԣ����ش��������⣺

��1���ڷ�Ӧ���У�ÿ���� 2.24L ����G����״����ʱ���÷�Ӧת�Ƶ��ӵ����ʵ����� mol��
��2������Ӧ���ڼ��������½��У�����A�ͻ�����B�����ʵ���֮��Ϊ1:2������Ӧ����C��D�����־���ʹ�����ʯ��ˮ����ǵ���ɫ���壬��Ӧ�ٵĻ�ѧ����ʽ�� ��
��3������Ӧ������Һ�н��У�A��һԪǿ�B��һ����ʽ�Σ�D��һ��ʹʪ���ɫʯ��
��ֽ���������壬��B������������ʹƷ����Һ��ɫ�����塣�ڼ��������£���A����ʱ��
��Ӧ�ٵ����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com