
| A. | 使用负催化剂 | B. | 改变浓度 | C. | 降低温度 | D. | 升高温度 |
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{83}^{209}$Bi比${\;}_{83}^{210}$Bi的质量数小1 | |
| B. | ${\;}_{83}^{209}$Bi和${\;}_{83}^{210}$Bi都含有83个中子 | |
| C. | ${\;}_{83}^{209}$Bi和${\;}_{83}^{210}$Bi的核外电子数不同 | |
| D. | ${\;}_{83}^{209}$Bi和${\;}_{83}^{210}$Bi分别含有126和127个质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
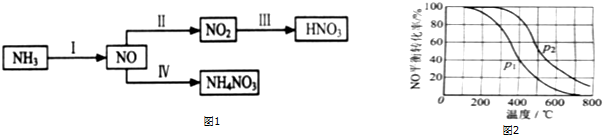
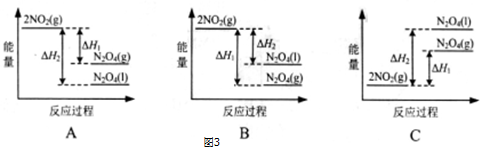
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳碳双键不可旋转所以烯烃一定有顺反异构 | |
| B. | 邻二甲苯只有一种结构可以证明苯分子中无单双健的交替结构 | |
| C. | CH2Cl2无同分异构体可以证明CH4是正四面体的结构 | |
| D. | 乙烯、乙炔是平面型分子,可知CH3-CH=C(CH3)-C≡C-CH3分子中所有的碳原子共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HOCH2CH(OH)CH2OH与CH3CHClCH2CH3都是手性分子 | |
| B. | NH3和CH4的空间构型相似 | |
| C. | BF3与 都是平面型分子 都是平面型分子 | |
| D. | CO2和H2O都是直线型分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,4,8 | B. | 3,4,8 | C. | 2,3,9 | D. | 3,4,9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 装置Ⅰ中不可能发生如下反应:Fe+2Fe3+=3Fe2+ | |
| B. | 装置Ⅱ在反应结束时溶液中存在Fe2+ | |
| C. | 装置Ⅰ的溶液若换为稀硝酸,则腐蚀过程与原装置不同 | |
| D. | 装置Ⅱ中的铁丝能发生电化学腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com