
分析 根据电池反应式知,Cu失电子发生氧化反应,则作负极,不如Cu活泼的金属或导电的非金属作正极,含有铁离子的可溶性铁盐溶液为电解质溶液,根据转移电子与Cu的关系式计算消耗Cu的质量,由此分析解答.
解答 解:根据电池反应式知,Cu失电子发生氧化反应,则作负极,不如Cu活泼的金属或导电的非金属作正极,正极电极反应式为:Fe3++e-═Fe2+,含有铁离子的可溶性铁盐溶液为电解质溶液,如FeCl3溶液;负极反应式为Cu-2e-=Cu2+,负极上铜失电子生成铜离子进入溶液,所以铜质量在不断减少,根据转移电子与Cu的关系式得消耗Cu的质量=$\frac{0.1mol}{2}$×64g/mol=3.2g;故答案为:Cu;氯化铁溶液;Fe3++e-═Fe2+;3.2.
点评 本题考查原电池设计,侧重考查学生设计及计算能力,会根据得失电子确定原电池正负极、电解质溶液,失电子的金属作负极、得电子的可溶性电解质溶液为该原电池电解质溶液,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
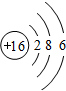 ,G元素形成的单质的结构式为Cl-Cl.
,G元素形成的单质的结构式为Cl-Cl. .
.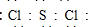 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
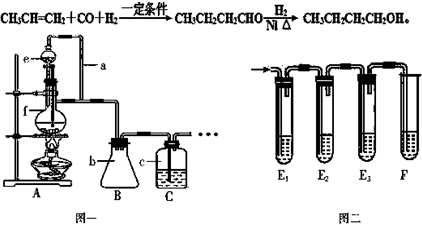

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)═xCO2(g)+$\frac{y}{2}$H2O(l)△H=(-Q+23.5)kJ•mol-1 | |
| B. | CxHy(l)+( x+$\frac{y}{4}$)O2═xCO2+$\frac{y}{2}$H2O(l)△H=?-$\frac{9Q}{10}$?kJ•mol-1 | |
| C. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)═xCO2(g)+$\frac{y}{2}$H2O(l)△H=-$\frac{9Q}{10}$ kJ•mol-1 | |
| D. | CxHy(l)+( x+$\frac{y}{4}$)O2(g)═xCO2(g)+$\frac{y}{2}$H2O(l)△H=(-$\frac{10Q}{9}$+2.61)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图中,AB段的反应为Fe+2Fe 3+=3Fe 2+,溶液中溶质最终为FeSO 4 | |
| B. | 原溶液中H2SO4浓度为2.5mol•L -1 | |
| C. | 原混合溶液中NO3-的物质的量为0.4mol | |
| D. | 图中,OA段产生的气体是NO,BC段产生的气体是氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1.5 mo1•L-1NaCl溶液 | B. | 75 mL 3 mol•L-1MgCl2溶液 | ||
| C. | 150 mL 2 mo1•L-1KCl溶液 | D. | 75 mL 1 mol•L-1A1C13溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com