
【题目】下列指定反应的离子方程式正确的是( )
A.Na2O2与H2O反应:2O![]() +2H2O===O2↑+4OH-
+2H2O===O2↑+4OH-
B.向Fe2(SO4)3溶液中加入足量Cu粉:2Fe3++3Cu===2Fe+3Cu2+
C.向NaHSO4溶液中加入Ba(OH)2溶液至中性:2H++SO![]() +Ba2++2OH-===BaSO4↓+2H2O
+Ba2++2OH-===BaSO4↓+2H2O
D.向银氨溶液中加入足量盐酸:[Ag(NH3)2]++2H+===Ag++2NH![]()
 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在固定容积的密闭容器中,可逆反应:mA(s)+nB(g) ![]() pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率vB∶vC∶vD=n∶p∶q,其中,能说明反应已达到平衡的是 ( )
pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率vB∶vC∶vD=n∶p∶q,其中,能说明反应已达到平衡的是 ( )
A. 只有③④B. 只有②③④C. 只有①②③④D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质.下列实验现象和结论一致且正确的是
A. 加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B. 溶液呈黄绿色,且有刺激性气味,说明有HClO分子存在
C. 加入AgNO3溶液产生白色沉淀,说明有Cl-分子存在
D. 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z和M在周期表中的位置如图所示,Y原子序数是X的2倍。下列说法不正确的是
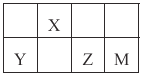
A. Z、M、X的简单离子半径依次减小
B. Y和M可形成离子化合物YM4
C. X的简单气态氢化物的稳定性强于Y的
D. M的最高价氧化物对应水化物的酸性比Z的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH= +49.0kJ/mol
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) ΔH= -192.9kJ/mol
O2(g)=CO2(g)+2H2O(g) ΔH= -192.9kJ/mol
由上述方程式可知:CH3OH的燃烧热____(填“大于”“等于”或“小于”)192.9kJ/mol。已知水的气化热为44kJ/mol。则表示氢气燃烧热的热化学方程式为___。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH= -159.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH= +116.5kJ/mol
③H2O(l)=H2O(g) ΔH= +44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式___。
(3)已知:①Fe(s)+![]() O2(g)=FeO(s) ΔH1= -272.0kJ/mol
O2(g)=FeO(s) ΔH1= -272.0kJ/mol
②2Al(s)+![]() O2(g)=Al2O3(s) ΔH2= -1675.7kJ/mol
O2(g)=Al2O3(s) ΔH2= -1675.7kJ/mol
Al和FeO发生铝热反应的热化学方程式是___。铝热反应的反应类型___,某同学认为,铝热反应可用于工业炼铁,你的判断是____(填“能”或“不能”),你的理由____。
(4)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。已知:25℃、101KPa下:
①H2(g)+![]() O2(g)=H2O(g) ΔH1= -242kJ/mol
O2(g)=H2O(g) ΔH1= -242kJ/mol
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) ΔH2= -676kJ/mol
O2(g)=CO2(g)+2H2O(g) ΔH2= -676kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应X2+3Y2=2XY3的能量变化如图所示,该反应的热化学方程式是( )
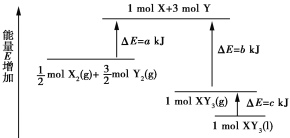
A.X2(g)+3Y2(g)=2XY3(l) ΔH =2(abc) kJ/mol
B.X2(g)+3Y2(g)=2XY3(g) ΔH =2(ba) kJ/mol
C.X2(g)+3Y2(g)=2XY3(l) ΔH =(b+ca) kJ/mol
D.X2(g)+3Y2(g)=2XY3(g) ΔH =(a+b) kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是 ( )
A. 2H+(aq) +![]() (aq)+
(aq)+![]() (aq)+2
(aq)+2![]() (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H![]() O(1)
O(1) ![]() H=
H=![]() 114.6 kJ/mol
114.6 kJ/mol
B. 2KOH(aq)+ H![]() SO4(aq)= K
SO4(aq)= K![]() SO4(aq)+2H
SO4(aq)+2H![]() O(l)
O(l) ![]() H=
H=![]() 114.6kJ/mol
114.6kJ/mol
C. C8H18(l)+ ![]() O
O![]() (g)=8CO
(g)=8CO![]() (g)+ 9H
(g)+ 9H![]() O
O ![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
D. 2C8H18(g)+25O![]() (g)=16CO
(g)=16CO![]() (g)+18H
(g)+18H![]() O(1)
O(1) ![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,3.36L氧气与3.2g硫反应,生成SO2分子数为0.1NA
B.1L0.1mol·L-1氨水中NH3·H2O分子数为0.1NA
C.标准状况下,1.12L氯气发生反应转移的电子数一定为0.1NA
D.46gNO2和N2O4混合气体中氧原子总数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍、钴及其化合物在工业上应用广泛。从某含镍废渣(含主要成分为Ni、CoO、Co2O3 及少量杂质Al2O3)提取碳酸钴、硫酸镍的工艺如下:

已知:25℃,Ksp[Co(OH)2]=4.0×10-15, lg2=0.3
(1)酸浸时需将含镍废渣粉碎,目的是_______,酸浸时通入SO2的作用是________。
(2)“除铝”时发生反应的离子方程式是______________________,25℃,若“沉钴”开始时c (Co2+) = 0.010 mo/L,则控制pH≤______时不会产生Co(OH)2沉淀。
(3)一定浓度的NiSO4溶液中加入适量的NaClO和NaOH混合液,可制得NiOOH沉淀,该反应的化学方程式为________。NiOOH可用于制备碱性镍氢电池,该电池工作原理: NiOOH+ MH![]() Ni(OH)2+M(M为储氢合金)电池充电时阳极的电极反应式是___________。
Ni(OH)2+M(M为储氢合金)电池充电时阳极的电极反应式是___________。
(4) NiSO4溶液可经过操作A得到NiSO4·7H2O晶体,俗称“翠矾”,操作A具体是指______________。煅烧该晶体时剩余固体质量与温度变化曲线如图,已知该曲线中D处所得产物均为氧化物,写出C到D的化学方程式______________。
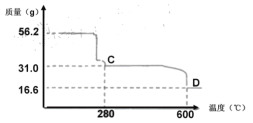
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com