
分析 ①碳链异构:相同碳原子,形成不同的骨架; ②位置异构还是同样的官能团(不过连的位置不同);
③组成相同而分子中的各种原子结合方式或顺序不同,因此有不同的官能团,这些化合物叫官能团异构,据此解答即可.
解答 解:(1)①1-丙醇和 2-丙醇含同样的官能团(不过连的位置不同)故属于官能团位置异构;
②CH3COOH 和 HCOOCH3含有的官能团不同,属于官能团异构;
③CH3CH2CHO 和 CH3COCH3含有的官能团不同,属于官能团异构;
④(CH3)3CH和 CH3CH2CH2CH3碳架结构不同,属于碳链异构;
⑤CH3CH=CHCH2CH2CH3 和 CH3CH2CH=CHCH2CH3含同样的官能团(不过连的位置不同)故属于官能团位置异构;
故答案为:官能团位置异构;官能团异构;官能团异构;碳链异构;官能团位置异构.
点评 本题主要考查了有机物结构以及同分异构体的不同类型,熟练掌握各种异构关系是解决本题的关键,难度不大.


科目:高中化学 来源: 题型:解答题
 化学实验有助于理解化学知识,提升科学素养.某学习小组在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关探究.
化学实验有助于理解化学知识,提升科学素养.某学习小组在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上常采用电解法冶炼Y 单质 | |
| B. | 气态氢化物的稳定性:H2W强于H2Z | |
| C. | 离子半径由大到小:W2->X+>Y3+>Z2-? | |
| D. | W、X 形成的化合物中阴、阳离子个数比一定是1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 键能 | 键能 | 键能 | 键能 | ||||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 | H-O | 464 |
| S=S | 255 | H-S | 339 | H-F | 565 | C-O | 347 |
| C-Cl | 330 | C-I | 218 | C-F | 427 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
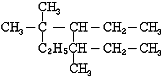 完成下列小题
完成下列小题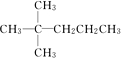 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K的相对原子质量比较大 | |
| B. | K可失的电子数较多 | |
| C. | K含有的电子数较多 | |
| D. | K和Na最外层电子数相同,但钾原子的半径较大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com