
| 键能 | 键能 | 键能 | 键能 | ||||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 | H-O | 464 |
| S=S | 255 | H-S | 339 | H-F | 565 | C-O | 347 |
| C-Cl | 330 | C-I | 218 | C-F | 427 |
分析 (1)比较半径与键能大小要在同一标准下进行,否则没有可比性,同主族元素的半径越大,键能越小;
(2)化学反应的反应热等于反应物的键能之和与生成物的键能之和的差.
解答 解:(1)由表中数据可知,原子半径F>H,但键能:H-F>H-H,则不能得出半径越小的原子形成的共价键越牢固的结论,Cl的非金属性大于H,但键能H-H>Cl-Cl,也不能说明非金属性越强的原子形成的共价键越牢固,由H-F、H-Cl、H-Br、H-I的键能可以看出,与相同原子结合时同主族元素形成的共价键,原子半径越小,共价键越强;Br的原子半径介于Cl与I之间,C-Br的键能介于C-Cl与C-I之间,即218KJ•mol-1~330 KJ•mol-1之间,
故答案为:①不能;②不能;与相同原子结合时同主族元素形成的共价键,原子半径越小,共价键越强;218KJ•mol-1,330 KJ•mol-1;
(2)已知:热化学方程式H2(g)+Cl2(g)→2HCl(g);△H=-185KJ•mol-1,
可得出△H=436kJ/mol+243kJ/mol-2×432kJ/mol=-185kJ/mol,则有化学反应的反应热等于反应物的键能之和与生成物的键能之和的差,
故答案为:化学反应的反应热等于反应物的键能之和与生成物的键能之和的差;
点评 本题考查新信息数据处理能力,断裂化学键难易与形成化学键的两个原子的性质有关,比较时要选择同一标准,否则不可比,依题意,C-Br键能介于C-I、C-Cl键能之间.根据反应的数据得出根据键能计算反应的规律,再运用这一规律.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如图所示,下列说法一定正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如图所示,下列说法一定正确的是( )| A. | 最高价氧化物对应水化物的酸性最强的是W | |
| B. | Y与Z只能形成一种化合物 | |
| C. | 简单阴离子还原性:Y>W | |
| D. | Z与Q形成的化合物可能含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
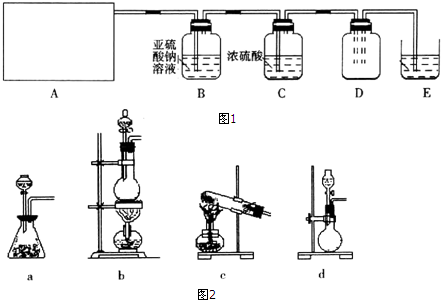
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量B中溶液于试管Ⅰ中,滴加过量稀盐酸和BaCl2溶液 | 若产生白色沉淀,则洗气瓶B溶液中存在SO42- |
| 步骤2:另取适量B中溶液于试管Ⅱ中,滴加过量Ba(NO3)2溶液,振荡,静置 | 产生白色沉淀 |
| 步骤3:取步骤2后试管Ⅱ中的上层清液于试管Ⅲ中,滴加稀HNO3和AgNO3溶液. | 若产生白色沉淀,则洗气瓶白溶液中存在Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
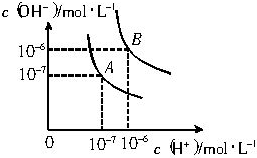 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
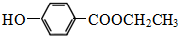
 .
.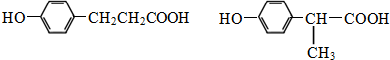 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com