
1200��ʱ���÷�Ӧ2BBr3(g)��3H2(g)![]() 2B(s)��6HBr(g)����ȡ���������������ա�
2B(s)��6HBr(g)����ȡ���������������ա�
1������˵����˵���÷�Ӧ�ﵽƽ�����________(ѡ����ţ���ͬ)��
a��v��(BBr3)��3v��(HBr)
b��2c(H2)��c(HBr)
c���ܱ�������ѹǿ���ٱ仯
d������������ƽ��Ħ���������ٱ仯
2�����ܱ�����������䣬�����¶ȣ���������������ӣ�����˵����ȷ����________��
a����ƽ���ƶ�ʱ����Ӧ������������С
b����ƽ���ƶ�ʱ�淴Ӧ����ʼ������
c������ӦΪ���ȷ�Ӧ
d���ﵽ��ƽ���Ӧ�ﲻ��ת��Ϊ������
3����������Ӧ��10 L���ܱ������ڷ�Ӧ��5 min����������������1.1 g�����ʱ�����������ƽ����Ӧ����Ϊ________��
4���������г���0.2 mol��BBr3��һ����H2����ַ�Ӧ�ﵽƽ����������HBr�ٷֺ�������ʼͨ��H2�����ʵ�������ͼ��ϵ��
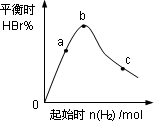
��a��b��c�����У�H2��ת������ߵ���________(ѡ����ĸ)��
b��ﵽƽ����ٳ���H2ʹƽ���c�㣬�˹�����ƽ���ƶ��ķ���Ϊ________(������������ƶ���)��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| 500-850�� |
| �����������Һ��ֱ�� | ��������ȫ�ѽ�����ʱ�� | |
| ��ͨ������ | 800-1200/��m | 10s���� |
| ��תʽ������ | 600-850 ��m | 8-10s |
| ѹ���������� | 400-650 ��m | 6-7s |
| ������������ | 100-300��m | 3.5-5s |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ���㽭ʡ�����и�����ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ʵ����
ͨ������������������������ˮ�����ٷ�Һ�ŷŶԻ�������Ⱦ��ͬʱ����
K2Cr2O7��ʵ���ҶԺ�����Һ������Cr3+��Fe3+��K+��SO42����NO3��������Cr2O72���������������ù������£�

��֪����Cr(OH)3+OH��=CrO2��+2H2O��
��2CrO2��+3H2O2+2OH��=2CrO42��+4H2O��
��H2O2�����������¾��л�ԭ�ԣ��ܽ�+6��Cr��ԭΪ+3��Cr��
��1��ʵ��������KOHŨ��Ϊ6 mol��L��1������KOH��������250mL 6 mol��L��1 ��KOH��Һ�����ձ����������⣬�������õ��IJ��������� ��
��2�����ں�����Һ�к���������K2Cr2O7������ʱ���� ���沼��©�������˹���
��Ҫ��ʱ�۲�����ƿ��Һ��߶ȣ�����ﵽ֧�ܿ�λ��ʱӦ���еIJ���Ϊ ��
��3����Һ���ữǰ�����м��ȵ�Ŀ���� ����ԡ�����˺�Ӧ��������ˮϴ��K2Cr2O7����Ŀ���� ��
��4���±���������ʵ��ܽ�����ݣ�
|
���� |
0�� |
20�� |
40�� |
60�� |
80�� |
100�� |
|
KCl |
28.0 |
34.2 |
40.1 |
45.8 |
51.3 |
56.3 |
|
K2SO4 |
7.4 |
11.1 |
14.8 |
18.2 |
21.4 |
24.1 |
|
K2Cr2O7 |
4.7 |
12.3 |
26.3 |
45.6 |
73.0 |
102.0 |
|
KNO3 |
13.9 |
31.6 |
61.3 |
106 |
167 |
246.0 |
�����ܽ�����ݣ�����������������Ϊ�� ���� ��
��5����ȡ��Ʒ�ظ��������2.000g���250mL��Һ��ȡ��25.00mL����ƿ�У�����10mL 2 mol��L��1H2SO4�������⻯�ƣ����Ļ�ԭ����ΪCr3+�������ڰ���5min��Ȼ�����100mLˮ������3mL����ָʾ������0.1200 mol��L��1Na2S2O3����Һ�ζ���I2+2S2O32��=2I��+S4O62������
����ʵ���й���ȥNa2S2O3����Һ30.00mL�����ò�Ʒ�����ظ���صĴ���Ϊ ���������������������ʲ����뷴Ӧ����
�����ζ�����ʹ��ǰδ��Na2S2O3����Һ��ϴ����õ��ظ���صĴ��Ƚ��� ���ƫ�ߡ�����ƫ�͡����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ���Ϻ��к����������ѧ����ĩ��ѧ�������л�ѧ�Ծ��������棩 ���ͣ������
1200��ʱ���÷�Ӧ 2BBr3(g)
+ 3H2(g) 2B(s)
+ 6HBr(g) ����ȡ���������������գ�
2B(s)
+ 6HBr(g) ����ȡ���������������գ�
��1������˵����˵���÷�Ӧ�ﵽƽ�����______��ѡ����ţ���ͬ����
a. v��(BBr3)= 3v��(HBr) b. 2c(H2) = c(HBr)
c.�ܱ�������ѹǿ���ٱ仯 d. ����������ƽ��Ħ���������ٱ仯
��2�����ܱ�����������䣬�����¶ȣ���������������ӣ�����˵����ȷ����_________��
a. ��ƽ���ƶ�ʱ����Ӧ������������С
b. ��ƽ���ƶ�ʱ�淴Ӧ����ʼ������
c. ����ӦΪ���ȷ�Ӧ
d. �ﵽ��ƽ���Ӧ�ﲻ��ת��Ϊ������
��3����������Ӧ��10L���ܱ������ڷ�Ӧ��5min����������������1.1 g�����ʱ�����������ƽ����Ӧ����Ϊ__________________��
��4���������г���0.2 mol BBr3��һ����H2����ַ�Ӧ�ﵽƽ����������HBr�ٷֺ�������ʼͨ��H2�����ʵ�������ͼ��ϵ����a��b��c�����У�H2 ��ת������ߵ���______��ѡ����ĸ����b��ﵽƽ����ٳ���H2ʹƽ���c�㣬�˹�����ƽ���ƶ��ķ���Ϊ__________��������������ƶ�������

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com