
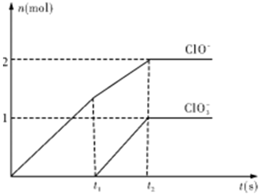
 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、Cl
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、Cl| O | - 3 |
| O | - 3 |
| n(ClO-) | ||
n(Cl
|
| O | - 3 |
| n(ClO-) | ||
n(Cl
|
| n(ClO-) | ||
n(Cl
|
| 5(a+5) |
| a+3 |
| 5(a+5) |
| a+3 |
| 5(a+5) |
| a+3 |
| 5(a+5) |
| a+3 |


科目:高中化学 来源: 题型:
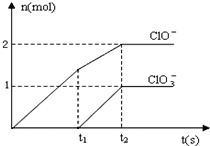 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示.
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示.| n(ClO-) | n(ClO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2013?江西模拟)已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、Cl
(2013?江西模拟)已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、Cl| O | - 3 |
| O | - 3 |
| O | n- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
(1)t2时,Ca(OH)2与Cl2发生反应的总化学方程式为:____________ 。
(2)该石灰乳中含有Ca(OH)2的物质的量是______ mol。
(3)据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通入Cl2的速度不同,C1O-和C1O3-的比例也不同。
若在原石灰乳中通入氯气的速度加快,则反应后![]() 2(填“>”、“<”或“=”);
2(填“>”、“<”或“=”);
若![]() ,则n(C1-)= mol(用含a的代数式来表示)。
,则n(C1-)= mol(用含a的代数式来表示)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年新疆乌鲁木齐地区高三第一次诊断性测验化学试卷(解析版) 题型:填空题
某校化学研究性学习小组对氯气的性质和用途进行了调查分析,了解了氯气能应用 于衣物漂白、水体的杀菌和消毒的原理。
(1) 氯气溶于水可用于漂白、消毒的原因是_______,反应的离子方程式为_______ ;
(2) 通常使用漂白液(NaClO溶液)作漂白剂而不用氯气的理由是_____(写出一项即可);
(3) 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应 (发生的反应均为放热反应)。最终生成物中含有Cl-、 ClO-、ClO3-三种含氯元素的离子,其中ClO-、ClO3-两种离 子的物质的量(n)与反应时间(t)的变化曲线如下图所示。
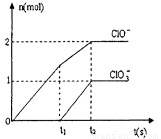
①O-t1时间内,Ca(OH)2与Cl2发生反应的化学方程式为_______;
②t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为_______
③该石灰乳中含有Ca(OH)2的质量是_______g;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com