

 ,
, ;
;
| ||
| △ |
| ||
| △ |


科目:高中化学 来源: 题型:
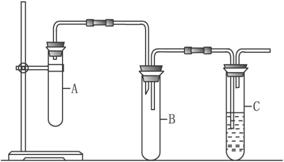
请回答下列问题。
(1)为了检验整套装置的气密性,某同学将导气管末端插入盛水的烧杯中,用双手捂着装置A中大试管,但几乎不能说明装置是否密闭。请回答如何检查装置气密性:______________。
(2)向装置A中大试管里先加入1,2二氯乙烷和NaOH的乙醇溶液,再加入___________,目的是__________________________________,并向装置C中试管里加入适量稀溴水。
(3)与装置A中大试管相连接的长玻璃管的作用是 _________________________________,装置B的作用是 ____________________________________________________________。
(4)证明1,2二氯乙烷已发生消去反应的现象是_______________________________________,还可通过什么实验加以验证:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:

Ⅰ.(1)实验开始时先打开活塞K持续通入N2一段时间后,并闭K。将铜丝(足量)下移伸入浓硝酸后,有大量的红棕色气体生成,随时间的进行,气体颜色逐渐变浅,当A中充满无色气体时:
①装置A中反应的离子方程式为___________________________。
②接下来的实验操作是___________________________________。
(2)本实验中装置A的优点是____________________________。
Ⅱ.将B中所得溶液稀释至200 mL,用0.20 mol/L的NaOH溶液进行滴定。实验数据如下(硝酸的挥发分解及溶液体积的变化忽略不计):
实验编号 | 待测液体积(mL) | NaOH溶液体积(mL) |
1 | 20.00 | 15.98 |
2 | 20.00 | 14.99 |
3 | 20.00 | 15.01 |
(1)待测液的浓度为____________mol/L。
(2)硝酸与铜反应主要生成NO时硝酸的浓度不大于____________mol/L。
查看答案和解析>>
科目:高中化学 来源:2010年湖北省武汉市武昌区高三五月调研测试理综化学试题 题型:填空题
(15分)硫酸亚铁药片(外表包有一层特质的糖衣)是一种治疗铁性贫血的药剂。某化学课外活动小组为测定其中硫酸亚铁的含量,进行如下实验:
I.甲同学要测定其中铁元素含量,实验按以下步骤进行:
请根据上面流程,回答以下问题:
(1)刮除药片的糖衣,甲同学如下称得样品ag,则你认为a=_____。
(2)将其碾碎后迅速溶解,配制250mL溶液。配制溶液时除烧杯、玻璃棒、量筒、250mL容量瓶外,还必须有的玻璃仪器__________。
(3)洗涤沉淀的操作是_____________________________________________。
(4)将沉淀物加热,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,据此结果,还应进行的操作是________________________________________。
根据测得的数据可计算出硫酸亚铁的含量。
II、乙同学根据反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,采用滴定的方法测定其中硫酸亚铁的质量分数。
(5)取上述甲同学所配置的待测液25.00mL置于锥形瓶中,并将0.02mol/L KMnO4的标准溶液装入_____(“酸式”或“碱式”)滴定管中,调节液面至“0”刻度。
(6)滴定操作时,眼睛注视_________________________。
(7)滴定待测液至终点,如此滴定三次,实验数据如下表所示:
(其中第一次滴定给点的数据如右图,请你你读得的数据填入表中)
样品中硫酸亚铁的质量分数为_____。(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源:2012届江苏省高二上学期期末考试化学试题(选修) 题型:实验题
已知1,2-二氯乙烷常温下为无色液体,沸点为83.5 ℃,密度为1.23 g·mL-1,难溶于水,易溶于醇、醚、丙酮等有机溶剂。乙醇的沸点为78.5 ℃。某化学课外活动小组为探究1,2-二氯乙烷的消去反应,设计了如图所示的实验装置(加热装置略去)。
(1)如图所示,连接好仪器装置之后,首先需进行的操作是 。
(2) 向装置A中大试管中加入1,2二氯乙烷和 (写名称);并向装置C中试管里加入适量溴水。A中发生反应的化学方程式是 。
(3)与装置A中大试管相连接的长玻璃管除导气外的作用是 __________________,装置B的作用是 _________________。
(4)证明1,2-二氯乙烷已发生消去反应的现象是_______________,还可通过什么实验加以验证:________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com