
【题目】已知下列微粒:①CH4 ②CH2=CH2③CH≡ CH④NH3 ⑤NH4+ ⑥BF3 ⑦H2O ⑧H2O2。试回答下列问题。
(1)分子空间构型为正四面体形的是__________(填序号,下同)。
(2)中心原子为sp3杂化的是__________,中心原子为sp2杂化的是__________,中心原子为sp1杂化的是__________。
(3)所有原子共平面(含共直线)的是__________,共直线的是__________。
【答案】①⑤ ①④⑤⑦⑧ ②⑥ ③ ②③⑥⑦ ③
【解析】
①CH4中C原子杂化轨道数![]() 键数+孤电子对数
键数+孤电子对数![]() ,所以C原子采取sp3杂化,CH4的空间构型为正四面体形;
,所以C原子采取sp3杂化,CH4的空间构型为正四面体形;
②CH2=CH2中C原子杂化轨道数![]() 键数+孤电子对数
键数+孤电子对数![]() ,所以C原子采取sp2杂化,CH2=CH2中所有原子共平面;
,所以C原子采取sp2杂化,CH2=CH2中所有原子共平面;
③CH≡CH中C原子杂化轨道数![]() 键数+孤电子对数
键数+孤电子对数![]() ,所以C原子采取sp1杂化,CH≡CH的空间构型为直线形;
,所以C原子采取sp1杂化,CH≡CH的空间构型为直线形;
④NH3中![]() 原子杂化轨道数
原子杂化轨道数![]() 键数+孤电子对数
键数+孤电子对数![]() ,所以N原子采取sp3杂化,NH3的空间构型为三角锥形;
,所以N原子采取sp3杂化,NH3的空间构型为三角锥形;
⑤NH4+中N原子杂化轨道数![]() 键数+孤电子对数
键数+孤电子对数![]() ,所以N原子采取sp3杂化,NH4+的空间构型为正四面体形;
,所以N原子采取sp3杂化,NH4+的空间构型为正四面体形;
⑥BF3中B原子杂化轨道数![]() 键数+孤电子对数
键数+孤电子对数![]() ,所以B原子采取sp2杂化,BF3的空间构型为平面三角形;
,所以B原子采取sp2杂化,BF3的空间构型为平面三角形;
⑦H2O中O原子杂化轨道数![]() 键数+孤电子对数
键数+孤电子对数![]() ,所以O原子采取sp3杂化,H2O的空间构型为V形;
,所以O原子采取sp3杂化,H2O的空间构型为V形;
⑧H2O2中O原子杂化轨道数![]() 键数+孤电子对数
键数+孤电子对数![]() ,所以O原子采取sp3杂化,H2O2中两个原子犹如在半展开的书的两面纸上并有一定夹角,两个O原子在书的夹缝上。
,所以O原子采取sp3杂化,H2O2中两个原子犹如在半展开的书的两面纸上并有一定夹角,两个O原子在书的夹缝上。
(1)分子空间构型为正四面体形的是①⑤(填序号,下同)。
故答案为:①⑤;
(2)中心原子为![]() 杂化的是①④⑤⑦⑧,中心原子为
杂化的是①④⑤⑦⑧,中心原子为![]() 杂化的是②⑥,中心原子为sp1杂化的是③。
杂化的是②⑥,中心原子为sp1杂化的是③。
故答案为:①④⑤⑦⑧;②⑥; ③ ;
(3)所有原子共平面(含共直线)的是②③⑥⑦,共直线的是③。
故答案为: ②③⑥⑦;③。


科目:高中化学 来源: 题型:
【题目】若在一定条件下,容积恒定的反应室中充入amolCO与2amolH2,在催化剂作用下发生反应CO(g)+2H2(g)![]() CH3OH(g),下列措施一定使
CH3OH(g),下列措施一定使![]() 增大的是( )
增大的是( )
A.升高温度B.充入Ar(g)使体系的总压增大
C.恒温恒容再充入H2D.恒温恒容再充入amolCO和2amolH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Ⅰ(C11H12O3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基.
Ⅰ可以用E 和H在一定条件下合成:

已知:①A的核磁共振氢谱表明其只有一种化学环境的氢;
②RCH=CH2![]() RCH2CH2OH
RCH2CH2OH
③化合物F苯环上的一氯代物只有两种;
④通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基
(1)A的化学名称为_____________;
(2)D的结构简式为_____________;
(3)I的结构简式为_____________;
(4)写出下列反应的类型:A→B:____________;C→D:____________;
(5)F生成G的化学方程式为:______________;
(6)I的同系物J比I相对分子质量小14,J能同时满足如下条件:①苯环上只有两个取代基,②能发生银镜反应,③能和饱和NaHCO3溶液反应放出CO2;符合上述条件的同分异构体共有__________种(不考虑立体异构).若J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A~D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。
元素 | A | B | C | D |
性质或结构信息 | 单质制成的高压灯发出的黄光透雾力强、射程远 | 工业上通过分离液态空气获得其单质。原子的最外层未达到稳定结构 | 单质在常温、常压下是气体,原子的 | 2价阳离子的核外电子排布与氖原子相同 |
(1)A与Cl形成的化合物为__________(填“离子”或“共价”)化合物,含有__________键。
(2)D和C形成的化合物中含有__________键。写出C单质与水反应的化学方程式:____________________。
(3)下列对元素B及元素B的常见单质描述正确的是__________(填序号)。
a.B元素的最高正价为+6
b.常温、常压下B的常见单质难溶于水
c.B的常见单质分子中含有18个电子
d.在一定条件下镁条能与B的常见单质反应
(4)若B与H能形成![]() ,则B为__________元素,
,则B为__________元素,![]() 中含有的化学键为__________。
中含有的化学键为__________。
(5)A和D两元素中金属性较强的是__________(写元素符号),写出能证明该结论的一个实验事实:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】百服宁口服液为解热镇痛药,主要用于治疗头痛、发烧。其主要化学成分的结构简式为
![]()
下列说法正确的是( )
A.该有机物的分子式为C8H10NO2
B.该有机物属于α-氨基酸
C.含有苯环且属于α-氨基酸的该有机物的同分异构体只有1种
D.该有机物不能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖在不同条件下可以转化成不同物质。
已知:RCOOH+CH2=CH2+![]() O2
O2![]() RCOOCH=CH2+H2O
RCOOCH=CH2+H2O
请回答下列问题:
(1)葡萄糖在酒化酶的催化作用下生成有机物A,A、B、C、D、E间的转化关系如图所示。
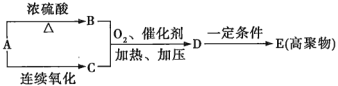
①B是石油化工中最重要的基础原料,写出A→B的化学方程式:_____________;
②D的结构简式为_____________。
(2)葡萄糖在一定条件下可以被氧化为X和Y(Y和A的相对分子质量相同,X的相对分子质量介于A、B之间)。X可催化氧化成Y,也可以与H2反应生成Z。X和Y的结构中有一种相同的官能团是__________,检验此官能团需要使用的试剂是___________。
(3)F是人体肌肉细胞中的葡萄糖在缺氧条件下进行无氧呼吸的产物。F、G、H间的转化关系如图所示:F ![]() G
G ![]() H
H
H与(1)中的D互为同分异构体。
①G还可以发生的反应有______(填序号);
a.加成反应 b.水解反应 c.氧化反应 d.消去反应 e.还原反应
②本题涉及的所有有机物中,与F不论以何种质量比混合(总质量一定),完全燃烧生成CO2和H2O的物质的量不变的有__________________(填结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁是一种银白色的碱土金属,镁元素在地壳中的含量约为2.00%,位居第八位,镁及其化合物在研究和生产中具有广泛用途。请回答下列问题:
(1)在室温下,纯净的氮化镁(Mg3N2)为黄绿色的粉末,能与水反应,常用作触媒,实验室用如图1所示装置和药品制备少量氮化镁。
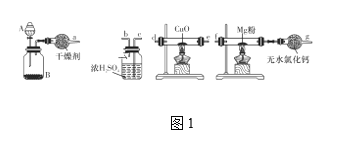
①A中盛装的是____,B中可盛装碱石灰,二者混合可制取氨气。
②按照气流的方向从左至右连接装置:a接____、____接____、_b__接____。
③气体通过CuO这一装置的目的是什么?用化学方程式回答:______。
④无水氯化钙装置可防止外界空气中的水进入,以防_____________(化学方程式表示)的发生。
(2)碳酸镁可用作耐火材料、锅炉和管道的保温材料,以及食品、药品、化妆品、橡胶、墨水等的添加剂。
Ⅰ.合成碳酸镁晶体的步骤如下:
步骤1:配制0.5 mol·L-1MgSO4溶液和0.5 mol·L-1NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL四口烧瓶中,开启搅拌器,温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完毕,然后用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤,洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得到产品碳酸镁晶体(MgCO3·nH2O,n=1~5)。
①配制0.5 mol·L-1MgSO4溶液500 mL,需要的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、____。
②步骤3中加氨水后发生反应的离子方程式为________________
Ⅱ.测定合成的MgCO3·nH2O中的n值。
称量1.000 g碳酸镁晶体,放入图2所示的广口瓶中,加入适量水,滴入稀硫酸与晶体反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,后期将温度升到30 ℃,最后烧杯中的溶液用已知浓度的盐酸滴定,测得生成CO2的总量;重复上述操作2次。
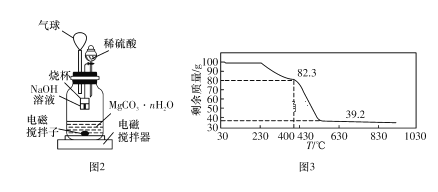
③上述反应后期要升温到30 ℃,主要目的是_____________________
④若实验测得1.000 g碳酸镁晶体产生CO2的平均物质的量为a mol,则n为__________(用含a的表达式表示)。
⑤若称取100 g上述晶体进行热重分析,得到的热重曲线如图3所示,则合成的晶体中n=____(取整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时将10mLpH=11的氨水加水稀释至100mL,下列判断正确的是
A.稀释后溶液的pH=7B.氨水的电离度增大,溶液中所有离子的浓度均减小
C.稀释过程中![]() 增大D.pH = 11氨水的浓度为0.001mol/L
增大D.pH = 11氨水的浓度为0.001mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com