
【题目】若在一定条件下,容积恒定的反应室中充入amolCO与2amolH2,在催化剂作用下发生反应CO(g)+2H2(g)![]() CH3OH(g),下列措施一定使
CH3OH(g),下列措施一定使![]() 增大的是( )
增大的是( )
A.升高温度B.充入Ar(g)使体系的总压增大
C.恒温恒容再充入H2D.恒温恒容再充入amolCO和2amolH2
科目:高中化学 来源: 题型:
【题目】下列实验中,能达到相应实验目的的是
|
|
|
|
A.制备并收集乙酸乙酯 | B.证明氯化银溶解度大于硫化银 | C.验证溴乙烷的消去产物是乙烯 | D.推断S、C、Si的非金属性强弱 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x=_________pm,Mg原子之间最短距离y=_________pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是_________g·cm-3(列出计算表达式)。

(2)一种四方结构的超导化合物的晶胞如图1所示。晶胞中Sm和As原子的投影位置如图2所示。图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为__________;通过测定密度![]() 和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=____g·cm-3。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子的坐标为(
和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=____g·cm-3。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子的坐标为(![]() ,
,![]() ,
,![]() )则原子2和3的坐标分别为__________、__________。
)则原子2和3的坐标分别为__________、__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠( Na2CO4)是一种很好的供氧剂,其与稀盐酸反应的化学方程式为:2Na2CO4+4HCl=4NaCl+2CO2 +O2+2H2O.市售过碳酸钠一般都含有碳酸钠,为测定某过碳酸钠样品(只含Na2CO4和Na2CO3)的纯度,某化学兴趣小组采用以下两种方案实施:
方案一:![]()
(1)操作①和③的名称分别为
(2)上述操作中,使用到玻璃棒的有 __(填操作序号)。
(3)请简述操作③的操作过程
方案二:按下图安装好实验装置,Q为一塑料气袋,随意取适量样品于其中,打开分液漏斗活塞,将稀盐酸滴入气袋中至充分反应。

(4)为测定反应生成气体的总体积,滴稀盐酸前必须关闭 ,打开 (填“K1”、“K2”或“K3”)。导管a的作用是 。
(5)当上述反应停止后,使K1、K3处于关闭状态,K2处于打开状态,再缓缓打开Kl。 B中装的固体试剂是 ,为何要缓缓打开K1? 。
(6)实验结束时,量筒I中有xmL水,量筒Ⅱ中收集到了ymL气体,则样品中过碳酸钠的质量分数是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅铬黄是一种颜料,主要成分是铬酸铅PbCrO4。现以CrCl36H2O 和 Pb(NO 3)2等为原料制备该物质,并测定产物纯度。

(1)溶解、过滤、洗涤操作时, 均需要用到的以下仪器为______________(填标号)。

(2)第①步所得绿色溶液的主要成分为 NaCrO2,已知 Cr(OH)3 不溶于水,与Al(OH)3类似,具有两性。写①步发生反应的离子方程式_____________________。
(3)第②步中加入H2O2 浓溶液的目的是___________________。溶液逐步变为亮黄色后,仍须持续煮沸溶液一段时间,目的是_____________________。
(4)第③步加入醋酸的目的是,防止pH 较高时,加入 Pb(NO3)2 溶液会产生______(填化学式)沉淀,影响产率。利用pH 试纸,调节 pH 的实验操作是_____________。pH逐步降低时, 溶液中的CrO42-转化为 ____________离子(填化学式)。
(5)由于铬酸铅的溶解度比重铬酸铅的小的多,在第④ 步中逐滴滴加 Pb(NO3)2溶液后,产PbCrO4黄色沉淀, 此时为了提高铅铬黄的产率,可补加少量NaOH溶液,请用化学平衡移动原理加以解释:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A. 0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)
B. pH=11的氨水和pH=3的盐酸溶液等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C. 在0.1 mol·L-1 Na2CO3溶液中:2c(Na+)=c(CO![]() )+c(HCO
)+c(HCO![]() )+c(H2CO3)
)+c(H2CO3)
D. 0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1 mol/L体积均为V0的HA、HB溶液分别加水稀释至体积为 V的溶液。稀释过程中,pH与![]() 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是
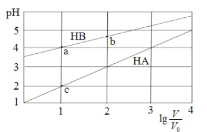
A.pH 随 ![]() 的变化始终满足直线关系
的变化始终满足直线关系
B.溶液中水的电离程度:a > b > c
C.该温度下,Ka(HB)≈ 10-6
D.分别向稀释前的HA、HB溶液中滴加 NaOH 溶液至 pH = 7 时,c(A-)= c(B-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(b)![]() 、(d)
、(d)![]() 、(p)
、(p)![]() 的分子式均为C6H6,下列说法正确的是
的分子式均为C6H6,下列说法正确的是
A. b的同分异构体只有d和p两种B. b、d、p的二氯代物均只有三种
C. b、d、p均可与酸性高锰酸钾溶液反应D. b、d、p中只有b的所有原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列微粒:①CH4 ②CH2=CH2③CH≡ CH④NH3 ⑤NH4+ ⑥BF3 ⑦H2O ⑧H2O2。试回答下列问题。
(1)分子空间构型为正四面体形的是__________(填序号,下同)。
(2)中心原子为sp3杂化的是__________,中心原子为sp2杂化的是__________,中心原子为sp1杂化的是__________。
(3)所有原子共平面(含共直线)的是__________,共直线的是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com