(2009?宿迁二模)实验化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌.同时,由于粗锌中还含有铁等杂质,使得溶液中混有一定量的硫酸亚铁,为了充分利用制氢废液,常用其制备皓矾(ZnSO
4?7H
2O).某校化学兴趣小组的同学以制氢气的废液为原料来制取皓矾并探究其性质.
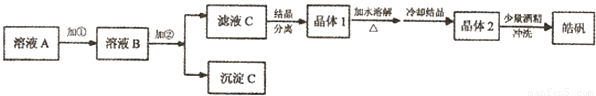
(1)制备皓矾的实验流程如图所示.
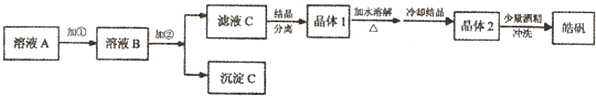
已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:
Fe(OH)
3:2.7一3.7
Fe(OH)
2:7.6一9.6
Zn(OH)
2:5.7一8.0
试回答下列问题:①加入的试剂①,供选择使用的有:氨水、NaClO溶液、20%的H
2O
2、浓硫酸、浓硝酸等,应选用
20%的H2O2
20%的H2O2
,其理由是
将制氢废液中的Fe2+氧化成Fe3+,同时避免引入新的杂质
将制氢废液中的Fe2+氧化成Fe3+,同时避免引入新的杂质
②加入的试剂②,供选择使用的有:Zn粉、ZnO、Zn(OH)
2、ZnCO
3、ZnSO
4等,应选用
ZnO、Zn(OH)2、ZnCO3
ZnO、Zn(OH)2、ZnCO3
,其理由是
调节溶液PH到3.7,使铁离子沉淀,同时不引入新的杂质
调节溶液PH到3.7,使铁离子沉淀,同时不引入新的杂质
③从晶体1→晶体2,该过程的名称是
重结晶
重结晶
.
④在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是
为了冲洗掉晶体表面的杂质离子;防止晶体溶解,影响产率
为了冲洗掉晶体表面的杂质离子;防止晶体溶解,影响产率
.
(2)探究ZnSO
4?7H
2O的性质
⑤称取28.7g ZnSO
4?7H
2O研细后置于坩埚中小心加热,测得残留固体的质量与温度的对应数据见下表:
| 温度(℃) |
60 |
240 |
930 |
1000 |
| 残留固体质量(g) |
19.7 |
16.1 |
8.1 |
8.1 |
试写出ZnSO
4?7H
2O加热到1000℃时的反应方程式
.
⑥取少量ZnSO
4?7H
2O配成溶液向其中逐滴加入NaOH溶液,发现先产生白色沉淀后又逐渐溶解;若改用氨水得到相同的现象.查资料知,氢氧化锌与氢氧化铝均有两性,且锌离子可与氨水形成络合离子[Zn(NH
3)
4]
2+.则Zn(OH)
2沉淀中加入NaOH溶液和加氨水均得到无色溶液的离子反应方程式为:
Zn(OH)2+2OH-=ZnO22-+2H2O
Zn(OH)2+2OH-=ZnO22-+2H2O
(任写一个).

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案