
【题目】以下是与氧气性质有关的实验,回答相关问题。
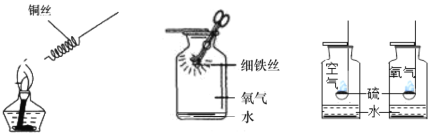
(1)写出铜和氧气反应的化学方程式__。
(2)写出铁丝在氧气中燃烧的化学方程式__,该反应的实验现象为__。
(3)硫燃烧时瓶底盛少量水的作用是__,硫在氧气中燃烧比在空气中燃烧更剧烈的原因是因为___不同。
【答案】2Cu+O2![]() 2CuO 3Fe+2O2
2CuO 3Fe+2O2![]() Fe3O4 剧烈燃烧,火星四射,放出热量,生成黑色固体 吸收生成的二氧化硫气体,防止污染空气 氧气浓度
Fe3O4 剧烈燃烧,火星四射,放出热量,生成黑色固体 吸收生成的二氧化硫气体,防止污染空气 氧气浓度
【解析】
(1)该实验的原理是:铜粉与氧气反应生成氧化铜;发生反应的化学方程式为 2Cu+O2![]() 2CuO;
2CuO;
(2)该铁丝在氧气中燃烧生成了四氧化三铁,该反应的化学方程式是:3Fe+2O2 Fe3O4 ;反应的实验现象是:剧烈燃烧,火星四射,生成黑色固体;
Fe3O4 ;反应的实验现象是:剧烈燃烧,火星四射,生成黑色固体;
(3)由于二氧化硫是对大气有污染的气体,做硫在氧气燃烧的实验时瓶底盛放少量水的作用是:吸收二氧化硫防止污染空气;
硫在空气中燃烧产生淡蓝色火焰、在氧气中燃烧蓝紫色火焰,氧气中氧气的浓度比空气中氧气的浓度要大。


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】农药波尔多液的主要成分是CuSO4,下列两个反应都有CuSO4生成。
①Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
②CuO+H2SO4=CuSO4+H2O
反应①的副产物SO2是大气污染物,可用NaOH溶液吸收,发生反应的化学方程式为( )
A.NaOH+SO2=Na2SO3
B.NaOH+SO2=Na2SO3+H2O
C.2NaOH+SO2=Na2SO3+H2O
D.2NaOH+SO2=2NaHSO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3-CH=CH2+HBr→CH3-CHBr-CH3(主要产物)。1mol某芳香烃A充分燃烧后可以得到8mol CO2和4mol H2O。该烃A在不同条件下能发生如下所示的一系列变化。
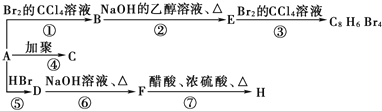
回答下列问题:
(1)A的分子式为_____________,E中官能团名称为___________。
(2)F的结构简式为_______________,③的反应类型为______________。
(3)写出下列反应的化学方程式:
② ________________________________;
④ ________________________________;
(4)下列关于F的说法正确的是_____(填序号)。
a.能发生消去反应 b.能与金属钠反应
c.1mol F最多能和3mol氢气反应 d.分子式是C8H9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从微观的角度认识化学变化有助于理解反应的实质,如图是氢气燃烧过程的微观示意图,其中“○”表示氢原子,“●”表示氧原子,从图中可获得的有关信息正确的是( )

①分子由原子构成;②原子是化学变化中的最小粒子;③有的物质由原子直接构成;④反应前框内的物质属于单质
A.①②③B.①②C.①②④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某兴趣小组对含有泥沙的粗盐进行提纯实验的流程图,请回答下列问题。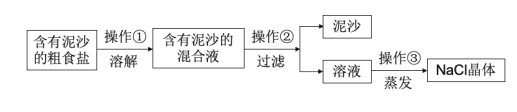
(1)操作②中用到的玻璃仪器是__。
(2)写出操作③中玻璃棒的作用__。
(3)若实验所得NaCl的产率偏低,则可能的原因__(填选项)。
A.过滤时滤纸有破损
B.蒸发时没有用玻璃棒搅拌
C.溶解含泥沙的粗盐时,加入水量不足
D.所得氯化钠晶体没有烘干,带有水分
E.过滤后的滤纸是湿的,纸上的水溶解了一些氯化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对下列实验现象表述不正确的是
A. 用同一针筒先后抽取80 mL氯气、20 mL水,振荡,气体完全溶解,溶液变为黄绿色
B. 在表面皿中加入少量胆矾,再加入3 mL浓硫酸,搅拌,固体由蓝色变白色
C. 向二氧化硫水溶液中滴加氯化钡溶液,再滴加双氧水,产生白色沉淀
D. 将点燃后的镁条伸入充满二氧化碳的集气瓶,镁条剧烈燃烧,有白色、黑色固体生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计用下图的装置制备少量的AlCl3(易水解)。下列说法错误的是( )

A. G装置作用是除去多余氯气,防止空气污染
B. 装置C和F中的试剂均为浓硫酸,其作用是防止水蒸气进人E中
C. 用50mL12mol/L的盐酸与足量的MnO2反应,所得氯气可以制取26.7gAlCl3
D. 实验过程中应先点燃A处的酒精灯,待装置中充满黄绿色气体时再点燃D处的酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒元素(Se)是第4周期ⅥA族元素,单质有红硒、黑硒和灰硒,灰硒是良好的半导体材料,硒最特殊的性质是在光照射下导电性可提高近千倍,可用于制造光电管。请回答下列问题:
(1)基态Se原子价电子的轨道表示式为__。
(2)As和Se是同一周期元素,As的第一电离能比Se大,原因是___。
(3)硒在空气中燃烧能生成SeO2,常温下,SeO2是易挥发的白色固体,熔点为340~350℃,315℃时升华,则SeO2固体是___晶体;写出一种与SeO2互为等电子体的阴离子的化学式__。
(4)H2SeO4和H2SO4相似,是一种不易挥发的强酸。SeO42-的空间构型为___,中心原子的杂化方式为___。
(5)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,Zn原子的配位数为___,若该晶胞密度为ρg·cm-3,硒化锌的摩尔质量为Mg·mol-1,用NA代表阿伏加德罗常数,则晶胞参数a(即晶胞的边长)为___nm。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com