
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如图所示。电池反应为Zn+2NiOOH+H2O ![]() ZnO+2Ni(OH)2。下列说法错误的是
ZnO+2Ni(OH)2。下列说法错误的是

A.放电过程中OH通过隔膜从负极区移向正极区
B.充电时阳极反应为Ni(OH)2+OHe=NiOOH+H2O
C.放电时负极反应为Zn+2OH2e=ZnO+H2O
D.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
科目:高中化学 来源: 题型:
【题目】2019年11月《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示(已知:H2O2![]() H+ + HO2-,Ka=2.4×10-12)。下列说法错误的是
H+ + HO2-,Ka=2.4×10-12)。下列说法错误的是
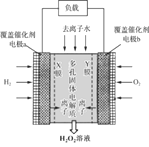
A.a极的电势低于b极
B.Y膜为选择性阴离子交换膜
C.每转移0.4 mol e-,就有0.1 mol H2O2生成
D.b极的电极反应为O2 + 2e- + H2O = HO2- + OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰硫酸![]() 是染料、医药等工业的重要原料;溶于浓硫酸,可在浓硫酸存在时用
是染料、医药等工业的重要原料;溶于浓硫酸,可在浓硫酸存在时用![]() 和浓硝酸反应制得。实验室用如图装置制备少量亚硝酰硫酸(夹持装置略),并测定产品的纯度。
和浓硝酸反应制得。实验室用如图装置制备少量亚硝酰硫酸(夹持装置略),并测定产品的纯度。
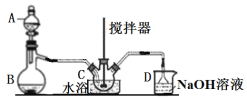
(1)仪器B的名称____________。
(2)B中产生SO2,其化学方程式为_______________________________________。
(3)三颈烧瓶C中浓硝酸与![]() 在浓硫酸作用下反应制得
在浓硫酸作用下反应制得![]()
①实验前浓硝酸和浓硫酸混合的操作为______________________________________。
②C中反应温度不能太高的原因为___________________________________。
③用冷水浴维持C温度不变,开始反应较慢,待生成少量![]() 后,反应明显加快,其原因可能是______________________。
后,反应明显加快,其原因可能是______________________。
(4)测定产品的纯度
准确称取1.5g产品放入锥形瓶中,加入![]() 、100.00mL的
、100.00mL的![]() 溶液和足量稀硫酸,摇匀充分反应。然后用0.5000mol/L草酸钠标准溶液滴定,消耗草酸钠溶液的体积为30.00mL。
溶液和足量稀硫酸,摇匀充分反应。然后用0.5000mol/L草酸钠标准溶液滴定,消耗草酸钠溶液的体积为30.00mL。
已知:![]()
①草酸钠与高锰酸钾溶液反应的离子方程式为__________________________________。
②滴定终点的现象为______________________________________________。
③亚硝酰硫酸的纯度![]() ________。[保留三位有效数字,M(NOSO4H)=127g/mol]
________。[保留三位有效数字,M(NOSO4H)=127g/mol]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较氧化性相对强弱:Cl2_______I2(填“)”>“<”或“=”);用一个离子方程式说明Cl2和I2氧化性的相对强弱_______。
(2)NH5是离子化合物,各原子最外层满足稳定结构。写出NH5的电子式__________。
(3)请用系统命名法对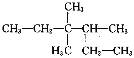 命名__________。
命名__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O
B.向KClO3溶液中滴加稀盐酸:ClO3-+Cl-+6H+=Cl2↑+3H2O
C.向Al2(SO4)3溶液中滴加过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含+6价铬的废水毒性强,对环境污染严重,工业上常利用化学原理把+6价铬转化为不溶性Cr(OH)3除去。
Ⅰ、SO2还原法:化工厂常用SO2处理含铬废水,其工艺流程如下图所示:
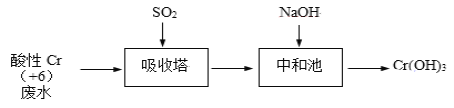
已知:Cr2O72- + H2O ![]() 2CrO42- + 2H+,吸收塔中 Cr2O72-与SO2反应如下:Cr2O72﹣(aq)+3SO2(g)+2H+(aq)═2Cr3+(aq)+3SO42﹣(aq)+H2O(l) ΔH = -1145 kJ/mol。
2CrO42- + 2H+,吸收塔中 Cr2O72-与SO2反应如下:Cr2O72﹣(aq)+3SO2(g)+2H+(aq)═2Cr3+(aq)+3SO42﹣(aq)+H2O(l) ΔH = -1145 kJ/mol。
(1)其他条件不变,研究吸收塔中pH对反应的影响。
pH | 2 | 4 | 6 |
Cr(+6)最大去除率 | 99.99%达排放标准 | 99.95%达排放标准 | 99.5%未达排放标准 |
时间 | 30 min | 35 min | 45 min |
①由上述数据获得的结论有_________。
②实际工业生产控制pH = ____左右。
③下列说法不合理的是_____。
a.该酸性含铬废水中一定含有CrO42-,pH越大其含量越高
b.其他条件不变,增大压强,吸收塔中反应的K增大,有利于除去Cr(+6)
c.理论上看,SO32-、Fe2+等也可以用于除去Cr(+6)
(2)其他条件不变,研究温度对Cr(+6)去除率的影响(如图所示)。
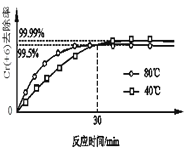
已知:30min前相同时间内,80℃的Cr(+6)去除率比40℃高,是因为30min前反应正向进行,温度高反应速率快反应物的转化率增大;试解释30min后80℃的Cr(+6)去除率低的原因:________。
Ⅱ、电解法处理:
工业上处理含Cr2O72-离子的酸性废水,采用往工业废水中加入适量的食盐,再用Fe为电极进行电解,将Cr2O72—离子还原为可溶性三价铬离子,再调pH使三价铬离子变为不溶性氢氧化物除去。
(1)加入食盐的目的是 _______;
(2)电解时阳极反应式为 _________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生产、生活等实际应用,不能用勒沙特列原理解释的是( )
A.冰镇的啤酒打开后泛起泡沫
B.实验室中常用排饱和食盐水的方法收集Cl2
C.工业合成氨时选择高温能极大加快反应速率
D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列各项叙述的判断及理由正确的是
选项 | 叙述 | 判断及理由 |
A | 糖类和油脂完全燃烧的产物是CO2和水 | 正确.糖类和油脂的组成元素是C、H、O |
B | 一定条件下乙醇、甲烷均能发生取代反应 | 错误.乙醇不能发生取代反应 |
C | 淀粉和纤维素是同分异构体 | 正确.淀粉和纤维素的化学式均为(C6H10O5)n |
D | 若乙烯中混有SO2气体,可通过酸性高锰酸钾溶液除去 | 正确.酸性条件下SO2可被高锰酸钾氧化 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物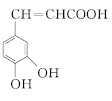 是一种重要的有机合成中间体,其合成路线如下:
是一种重要的有机合成中间体,其合成路线如下:
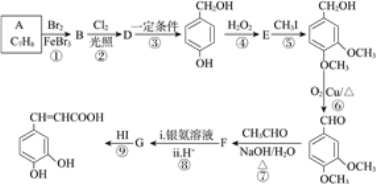
已知:①B的核磁共振氢谱有三个吸收峰;
②![]()
![]()
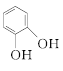 ;
;
③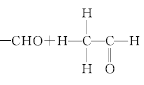
![]()
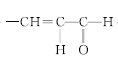 +H2O 。
+H2O 。
(1)B的名称为____________。
(2)反应⑤的反应类型为__________。G的结构简式为_______________。
(3)在合成路线中设计⑤和⑨两步反应的目的是________________。
(4)反应⑥的化学方程式为__________________。
(5)F与银氨溶液反应的化学方程式为________________。
(6)M为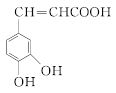 的同分异构体,满足下列条件的M的结构有________种。任写一种核磁共振氢谱有4组峰的M的结构简式_________________。
的同分异构体,满足下列条件的M的结构有________种。任写一种核磁共振氢谱有4组峰的M的结构简式_________________。
a.属于芳香族化合物 b.1 mol M与足量NaHCO3溶液反应能生成2 mol CO2
(7)参照上述合成路线,以乙醇为原料(其他无机试剂任选),设计制备正丁醇的合成路线_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com