
钴及其化合物在工业中运用广泛,从某工业废料中制备草酸钴的工业流程如图:
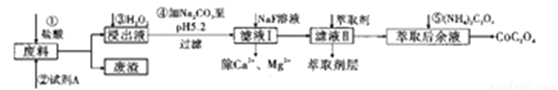
已知:①废料中主要含有三氧化二钴。含少量F2O3、Al2O3、MnO、CaO、SiO2等;
②浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:

(1)在浸出过程中加入Co2O3与盐酸反应生成气体,此反应的离子方程式为___________________ ;实验室中检验该气体的方法是________________。
(2)加入试剂A的目的是_________________,废渣的主要成分是_______________,在浸出液中先加入双氧水反应,再加入碳酸钠的原因是(试用离子方程式和必要的文字简述其理)___________。
(3)萃取后余液中加入(NH4)2C2O4沉淀Co2+,判断Co2+沉淀完全的操作是____________________。
(4)萃取剂对金属离子的萃取率与pH的关系如下图所示,在滤液II中适宜萃取的pH为_____(填序号)
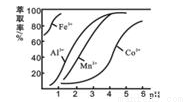
A.接近2.0 B. 接近3.0 C. 接近5.0
(5)在空气中加热CoC2O4固体,经测定,210℃~290℃的过程中只产生CO2和一种化合物,该化合物中钴元素的质量分数为73.44%。此过程发生反应的化学方程式是________________________。
科目:高中化学 来源:2016-2017学年黑龙江省牡丹江市高一下学期开学检测化学试卷(解析版) 题型:选择题
实验室为了制取干燥的氨气,下列方法中适合的是( )
A. NH4Cl和H2SO4(浓)混合加热,生成的气体用碱石灰干燥
B. N2 + H2 → NH3 ,用烧碱干燥
C. 氯化铵和氢氧化钙固体混合加热,气体用碱石灰干燥
D. 向浓氨水中加入生石灰,气体用浓硫酸干燥
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省安庆市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列操作能达到实验目的或不影响实验的是
A. 容量瓶用水洗净后,可不经干燥直接用于配制溶液
B. 向煮沸的1 mol/L NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体
C. 向溶液中滴加盐酸酸化的氯化钡,若有白色沉淀,说明溶液中含硫酸根
D. 蒸馏时应先加热然后再通冷凝水
查看答案和解析>>
科目:高中化学 来源:湖南省长沙市2016-2017学年高一上学期期末考试化学试卷 题型:选择题
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加人稍过量的NaOH溶液:③加人稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是
A. ③②①⑤④ B. ①②③⑤④
C. ②③①④⑤ D. ③⑤②①④
查看答案和解析>>
科目:高中化学 来源:湖南省长沙市2016-2017学年高一上学期期末考试化学试卷 题型:选择题
我国重点城市近年来已发布“空气质量日报”。下列物质中不列入污染指数的是
A. 二氧化硫 B. 二氧化氮 C. 二氧化碳 D. 可吸人颗粒物
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三高考适应性月考(六)理综化学试卷(解析版) 题型:选择题
一定条件下,下列各组物质之间不能通过一步反应实现如图所示转化关系是

选项 | X | Y | Z | W |
A | Mg | Mg3N2 | MgCl2 | Mg(OH)2 |
B | Al | NaAlO2 | Al(OH)3 | AlCl3 |
C | N2 | HNO3 | NO | NO2 |
D | NaCl | Cl2 | HCl | HClO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届云南省昆明市新课标高三月考卷(六)理综化学试卷(解析版) 题型:简答题
某学习小组利用反应:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O H2C2O4来探究“外界条件对化学反应速率的影响”。实验时,先分别量取KMnO4酸性溶液、H2C2O4溶液,然后倒入大试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。
(1)该反应是溶液之间发生的不可逆反应,改变压强对其反应速率的影响是______(填序号)。
A.可能明显加快 B.可能明显减慢 C.几乎无影响,可以忽略
(2)甲同学设计了如下实验
实验编号 | H2C2O4溶液 | KMnO4溶液 | 温度/℃ | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | ||
a | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
B | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
c | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
①探究温度对化学反应速率影响的组合实验编号是__________,可探究温度对化学反应速率影响的实验编号是__________。
②实验a测得混合后溶液褪色的时间为40%,忽略混合前后 体积的微小变化,则这段时间内的平均反应速率v(KMnO4)=______。
(3)在其它条件相同的情况下,乙同学用不同浓度的KMnO4酸性溶液实验,测得实验数据如下表所示:
实验编号 | 温度℃ | H2C2O4溶液 | KMnO4酸性溶液 | 褪色的时间(min) | |||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | ||||
1 | 25 | 0.10 | 4 | 0.2 | 8 | t1 | |
2 | 25 | 0.010 | 4 | 0.2 | 8 | t2(t2<t3) | |
依据表中数据,_____(填“能”或“不能”)得出“溶液褪色所需时间越短,反应速率越快”的结论,理由是__________________。
(4)在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快。
①同学们据此提出以下假设:
假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:反应生成的K+或SO42-该反应有催化作用
丙同学认为假设3不合理,其理由是__________。
②丁同学用如下实验证明假设2成立:在A和B两支试管中分别加入4mL0.2mol·L-1草酸溶液,再在A试管中加入lmL0.1mol·L-1MnSO4溶液、B试管中加入1mL蒸馏水,然后在两支试管中同时分别加入1mLO.1mol·L-1KMnO4酸性溶液,A试管溶液褪色的时间明显早于B试管。在B试管中加入1mL蒸馏水的目的是:__。
③同学们认为不宜用MnCl2溶液代替MnSO4溶液对该反应进行催化探究,其原因是(用离子方程式表示)_______________。
查看答案和解析>>
科目:高中化学 来源:2017届福建省晋江市等四校高三第二次联合考试理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 常温常压下,22.4LNH3中存在共价键的总数为3NA
B. 100g46%的乙醇溶液中含有氢原子数为12NA
C. 0.1mol氯气溶于水和水反应,转移的电子数为0.1NA
D. CH3COONa溶液中,若CH3COO?的数目为NA,则Na+的数目为NA
查看答案和解析>>
科目:高中化学 来源:2017届江西省、临川一中高三1月联考理综化学试卷(解析版) 题型:选择题
实验测得pH =1.0的某溶液中还可能大量存在:Na+、Fe2+、Al3+、NH4+、SO42-、Cl-中的若干种离子,现进行了如下实验:
步骤I:取该溶液10.0 mL,加入过量1.0 mol•L-1 Ba(NO3)2溶液,产生白色沉淀A和无色气体B,B遇空气立即变为红棕色;
步骤Ⅱ:向I所得的溶液中加入过量1.0 mol•L-1 NaOH溶液,有红褐色沉淀C和无色刺激性气体D生成。用铂丝蘸取所得溶液,在火焰上灼烧,火焰呈黄色;
步骤Ⅲ:向Ⅱ所得的溶液中通入过量CO2有沉淀E生成。
下列推断错误的是()
A. CO2先后分别与NaOH(aq)、NaAlO2( aq)反应
B. 原溶液一定含有:Na+、Fe2+、Al3+、SO42-
C. 步骤I中白色沉淀A的化学式为BaSO4
D. 步骤Ⅱ中产生沉淀C的反应:Fe3++3OH-=Fe(OH)3↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com