
实验室为了制取干燥的氨气,下列方法中适合的是( )
A. NH4Cl和H2SO4(浓)混合加热,生成的气体用碱石灰干燥
B. N2 + H2 → NH3 ,用烧碱干燥
C. 氯化铵和氢氧化钙固体混合加热,气体用碱石灰干燥
D. 向浓氨水中加入生石灰,气体用浓硫酸干燥
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2017届江西省高三2月月考理科综合化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A. 非金属单质中一定存在共价键
B. 金属元素和非金属元素形成的化合物一定是离子化合物
C. 含共价键的化合物不一定是共价化合物
D. 溶于水能导电的化合物就是离子化合物
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高一上学期期末考试化学试卷(解析版) 题型:填空题
氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙.
[查阅资料]
氢化钙通常用氢气与钙加热制得.
氢化钙要密封保存,遇水反应生成氢氧化钙和氢气.
钙遇水立即发生剧烈反应生成氢氧化钙和氢气,并放出大量的热.
标准状况下氢气的密度为0.09g/L.
[进行实验]小组同学设计的制取装置如图所示(固定装置略).

回答下列问题:
(1)写出A中发生反应的化学方程式______________________________.
(2)B、D中所盛试剂相同,该试剂为_____________,其作用分别是____________________、___________________________.
(3)实验时先打开A中活塞,一段时间后,再点燃C中酒精灯,其目的是__________________.
(4)装置C中制取氢化钙的化学方程式是______________________.
[实验反思]小组同学通过反思提出问题:上述制得的氢化钙是否纯净?
他们再次设计实验进行检验,实验步骤如下:
步骤1:检查装置气密性,装入足量的水和已称好质量的氢化钙样品,按图所示连接仪器(固定装置略).

步骤2:将Y形管倾斜,使A中的水全部进入B中,完全反应后,冷却至室温,读取量筒读数.
(5)通过上述实验可分析出制得的氢化钙是否纯净,其依据是______________________________.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列反应的产物颜色按红色、红褐色、淡黄色、蓝色顺序排列的是( )
①金属钠在纯氧中燃烧;②FeSO4溶液中滴入NaOH溶液并在空气中放置一段时间;
③FeCl3溶液中滴入KSCN溶液;④无水硫酸铜放入医用酒精中
A. ②③①④ B. ③②①④ C. ③①②④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省牡丹江市高一下学期开学检测化学试卷(解析版) 题型:选择题
相同质量的四份铜片,分别置于足量下列酸中,所得气体的物质的量最多的是( )
A. 稀硫酸 B. 浓硫酸 C. 稀硝酸 D. 浓硝酸
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省牡丹江市高一下学期开学检测化学试卷(解析版) 题型:选择题
对于反应 3 Cu + 8 HNO3 = 3 Cu(NO3)2 + 2NO↑+ 4H2O,以下叙述正确的是( )
A. 氧化剂和还原剂的物质的量比为8: 3
B. 被还原的HNO3和起酸性作用的HNO3的物质的量的比为2∶3
C. 该反应的电子转移数为6e-
D. 该反应中Cu(NO3)2 为氧化产物,H2O为还原产物
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省牡丹江市高一下学期开学检测化学试卷(解析版) 题型:选择题
合金是一类用途广泛的金属材料,下列物质中属于合金的是( )
A. 钢 B. 水银 C. 金刚石 D. 四氧化三铁
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省安庆市高一上学期期末考试化学试卷(解析版) 题型:选择题
有MgSO4、AlCl3、NH4Cl、(NH4)2SO4、NaCl等五种溶液,只用一种试剂就可把它们鉴别开来,这种试剂是
A. 盐酸 B. NaOH溶液
C. BaCl2溶液 D. Ba(OH)2溶液
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三高考适应性月考(六)理综化学试卷(解析版) 题型:简答题
钴及其化合物在工业中运用广泛,从某工业废料中制备草酸钴的工业流程如图:
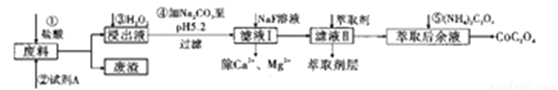
已知:①废料中主要含有三氧化二钴。含少量F2O3、Al2O3、MnO、CaO、SiO2等;
②浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:

(1)在浸出过程中加入Co2O3与盐酸反应生成气体,此反应的离子方程式为___________________ ;实验室中检验该气体的方法是________________。
(2)加入试剂A的目的是_________________,废渣的主要成分是_______________,在浸出液中先加入双氧水反应,再加入碳酸钠的原因是(试用离子方程式和必要的文字简述其理)___________。
(3)萃取后余液中加入(NH4)2C2O4沉淀Co2+,判断Co2+沉淀完全的操作是____________________。
(4)萃取剂对金属离子的萃取率与pH的关系如下图所示,在滤液II中适宜萃取的pH为_____(填序号)
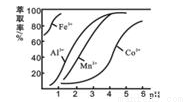
A.接近2.0 B. 接近3.0 C. 接近5.0
(5)在空气中加热CoC2O4固体,经测定,210℃~290℃的过程中只产生CO2和一种化合物,该化合物中钴元素的质量分数为73.44%。此过程发生反应的化学方程式是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com