
在化学实验中有时可以不使用任何化学试剂,通过相互滴加的方法就能将两种物质鉴别开来,下列各组中不能用此法鉴别的是(_____)
A.KOH和Al2(SO4)3 B. NaOH和Ca(HCO3)2
C. NaAlO2和 HCl D. K2CO3和HNO3
科目:高中化学 来源:2017届海南省高三第七次月考化学试卷(解析版) 题型:选择题
下列有关实验安全的说法不正确的是:
A. 不慎将试验台上的酒精灯碰翻着火时,立即用湿抹布盖灭
B. 不慎将浓硫酸沾到皮肤上,应迅速用水冲洗,再涂上稀NaHCO3溶液
C. 如果将苯酚溶液沾到皮肤上,应立即用酒精或NaOH溶液擦洗
D. 若不慎将水银温度计打碎时,应立即撒上一层硫粉
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三3月选考化学试卷(解析版) 题型:选择题
下列说法不正确的是
A. HF比H2O稳定性更强,是由于HF分子间作用力较大
B. CCl4、N2和SiO2晶体中,各原子最外层都达到8电子稳定结构
C. Na投入到水中,有共价键的断裂与形成
D. 离子化合物中一定含有离子键,可能含有共价键
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高一下学期开学考试化学试卷(解析版) 题型:选择题
现有CuO和Fe3O4的混合物7.2g,向其中加入1mol·L-1的H2SO4溶液150mL恰好完全反应,若将14.4 g该混合物用足量CO还原,充分反应后剩余固体质量为( )
A. 3.2g B. 4.8g C. 6g D. 9.6g
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高一下学期开学考试化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A. 明矾[KAl(SO4)2•12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
B. 江河入海口三角洲的形成通常与胶体的性质有关
C. 用激光笔检验淀粉溶液的丁达尔效应
D. 纳米材料属于胶体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆哈密地区第二中学高二上学期期末考试化学试卷(解析版) 题型:实验题
实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图所示)。
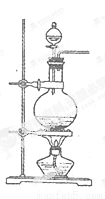
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是_(填序号)
A.往烧瓶中加人MnO2粉末
B.加热
C.往烧瓶中加人浓盐酸
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
丁方案:与足量Zn 反应,测量生成的H2体积。
继而进行下列判断和实验:
① 判定甲方案不可行,理由是 。
② 进行乙方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00 mL,用0 . 1000 mol·L-1NaOH标准溶液滴定,消耗22.00mL,该次滴定测得试样中盐酸浓度为 mol·L-1
b.平行滴定后获得实验结果。
③ 判断丙方案的实验结果 (填“偏大”、“偏小”或“准确”)。
[已知:Ksp(CaCO3) = 2.8×10-9、Ksp(MnCO3) = 2.3×10-11
④ 进行丁方案实验:装置如图所示(夹持器具已略去)。

(i) 使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中。
(ii)反应完毕,每间隔1 分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是_(排除仪器和实验操作的影响因素)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆哈密地区第二中学高二上学期期末考试化学试卷(解析版) 题型:选择题
已知:Fe2O3(s)+ C(s)===
C(s)=== CO2(g)+2Fe(s) ΔH=+234.14 kJ/mol,
CO2(g)+2Fe(s) ΔH=+234.14 kJ/mol,
C(s)+O2(g)===CO2(g)ΔH=-393.5 kJ/mol,
则2Fe(s)+ O2(g)===Fe2O3(s)的ΔH是( )
O2(g)===Fe2O3(s)的ΔH是( )
A. -824.4 kJ/mol B. -627.6 kJ/mol
C. -744.7 kJ/mol D. -169.4 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三下学期第一次月考理科综合化学试卷(解析版) 题型:填空题
甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)反应②是________________(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如左下图所示。则平衡状态由A变到B时,平衡常数K(A)_____________K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示)。

(3)在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如右上图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是_____________________。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_____________________。
(4)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。
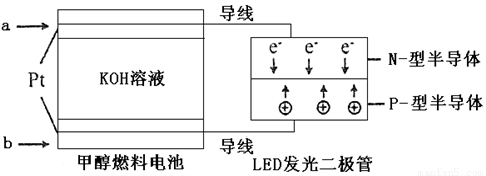
请写出加入(通入)b物质一极的电极反应式_________________;
每消耗6.4g甲醇转移的电子数为_______________。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合后,溶液中:2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com