
| ||


科目:高中化学 来源:知识精讲与能力训练 高三化学 题型:058
某种碱式碳酸铜是孔雀绿色固体粉末,其组成可表示为Cu2(OH)2CO3·xH2O.
在加热的条件下,它在失去结晶水的同时发生分解,反应方程式是
Cu2(OH)2CO3·xH2O![]() 2CuO+CO2↑+(x+1)H2O
2CuO+CO2↑+(x+1)H2O
现取一定量该固体样品,不准确称量其质量,用两套仪器装置,先后进行两个实验:
实验(Ⅰ)测定该碱式碳酸铜粉末组成中结晶水x的值;实验(Ⅱ)用实验(Ⅰ)结束后的残留固体与乙醇蒸气反应,并检验反应产物.

试回答下列问题:
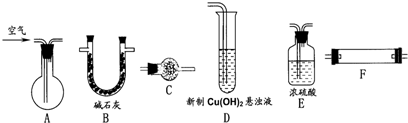
(1)现已装配好下面一套仪器装置(参见图示),装置中必要的铁架台、铁夹、铁圈、酒精灯、石棉网在图中均已略去),这套装置是用来完成上述的实验________的.(填标号).
(2)用图示的仪器(必要的铁架台、铁夹、酒精灯均在图中略去)组装完成另一个实验的实验装置.组装好仪器按气流方向从左到右连接顺序是________→________→________→________.
在这套实验装置中,干燥管H的作用是________.
(3)实验开始时,碱式碳酸铜放在仪器(填装置对应字母)________中,乙醇放在仪器(填装置对应字母)________中.
(4)这两套装置中,在实验时需要加热的仪器是(填装置对应字母)________.
(5)实验结束后可见试管D的内壁有银白色金属析出.实验中试管A内发生反应的化学方程式是________,从试管A通入试管D的导管中气体的成分是(写名称,其中水蒸气不必写出)________.
(6)这两套装置中,在实验前后均要连同所盛试剂一起准确称量的仪器是(填装置对应字母)________;若用托盘天平称量,其中某次称量记录的数据是51.12g.这样记录是否合理?________(填“合理”或“不合理”).
查看答案和解析>>
科目:高中化学 来源:考必通高考复习经典设计 题型:058
某种碱式碳酸铜其组成可表示为 ,在加热的条件下,反应为
,在加热的条件下,反应为
 2CuO+
2CuO+ ↑+(x+1)
↑+(x+1) ,某同学粗略取一定样品,先后进行两个实验:实验(Ⅰ):测定
,某同学粗略取一定样品,先后进行两个实验:实验(Ⅰ):测定 中x的值.实验
中x的值.实验
(Ⅱ)用实验(Ⅰ)中所得固体与氢气反应.
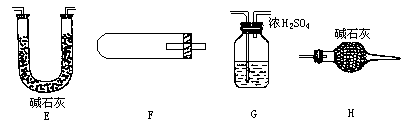
(1)现已装置好如下图所示的实验装置甲、乙,装置中一些附加设置均已略去,其中________是用来完成上述实验________的(填标号).为安全起见,本实验开始后应在你选用的装置的B处________.

(2)用下图中的仪器(必要的铁架台、铁夹、酒精灯均在图中略去)组装一个实验装置,完成另一个实验.组装时,仪器按气流方向从左到右连接顺序为________→________→________→________,这套装置中,H的作用是什么________.
(3)为测定和计算碱式碳酸铜粉末中的x值,某个细心的同学在实验前后准确称量了一些仪器的质量(连同所盛试剂)分别记为 (F装置连同药品反应前后的质量差,取正值,下同)、
(F装置连同药品反应前后的质量差,取正值,下同)、 ,为求x,这几个数据可用的是________,它们的组合有________种.
,为求x,这几个数据可用的是________,它们的组合有________种.
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省青岛市高三3月第一次模拟考试(第二套)理综化学试卷(解析版) 题型:填空题
碱式碳酸铜和氯气都是用途广泛的化工原料。
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl?)制备碱式碳酸铜,其制备过程如下:

已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
开始沉淀pH | 4.2 | 5.8 | 1.2 |
完全沉淀pH | 6.7 | 8.3 | 3.2 |
①氯酸钠的作用是???????????? ;
②反应A后调节溶液的pH范围应为?????????????????????????? 。
③第一次过滤得到的产品洗涤时,如何判断已经洗净????????????????????? 。
④造成蓝绿色产品中混有CuO杂质的原因是???????????????????? 。
(2)某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
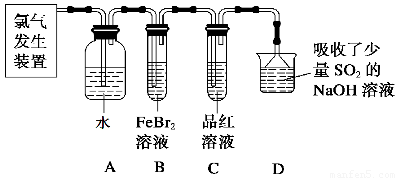
①实验室用二氧化锰和浓盐酸加热制取氯气,所用仪器需要检漏的有??? ????????? ????? 。
②若C中品红溶液褪色,能否证明氯气与水反应的产物有漂白性,说明原因 ????????? ?? 。此时B装置中发生反应的离子方程式是___________?????????????? _____。
③写出A溶液中具有强氧化性微粒的化学式????????? ??????????????????? ?? 。若向A溶液中加入NaHCO3粉末,会观察到的现象是????????????????????? 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com