
����Ŀ����0.4mol X�����0.6mol Y��������2L�ܱ������У�ʹ���Ƿ������·�Ӧ��4X��g��+5Y��g���TnZ��g��+6W��g����2minʱ����0.3mol W����ʱ��֪��Z��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.05molL��1min��1��
�Լ��㣺
��1��ǰ2min����X��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ���٣�____
��2������nֵ��2minĩʱY��Ũ�ȣ�д����Ҫ�ļ�����̣���______
��3�������½�n���pH=10��m���pH=13����NaOH��Һ��ϵ�pH=12��NaOH��Һ����n��m=________
���𰸡�0.05molL-1min-1 4��0.175molL-1 100��11
��������
���⿼����ǻ�ѧ��Ӧ���ʡ�
��1���ͣ�2������![]() ������ʽ���н��
������ʽ���н��
��3����С���ǹ������ֲ���Ӧ����Һ��Ϻ���ҺpHֵ�ļ��㣬���ݻ��ǰ������(NaOH)���غ㣬��ʽ��⡣�йػ����Һ��pH���㣬����������ǧ������������˼ά����������ĸ������֣�����������ֻ�����֣���1����Ϻ�Ӧ����2����Ϻ�Ӧ��������Һ��ϡ�ͣ��ɽ�ˮ��ΪŨ��Ϊ0����Һ��������Ϻ�Ӧһ�࣬��һ������Һ��pHӦ����������Һ��pH֮�䣬����ᡢ����Һ���ۼӶ���ˮϡ�ͣ�������pH�������ܵ��ڴ�ˮ��pH�������²�����Ϊ7���������ҺpH�ļ��㷽��Ҳ�ܼ����跨��������Һ��C(H + )��������Һ�Լ��ԣ�������������Һ��c(OH �� )��Ȼ���ٻ���Ϊc(H + )��OH �� ���غ���ʽ��⡣
��1���仯��֮�ȵ��ڻ�ѧ������֮�ȣ���W�ı仯�����������X��Ũ�ȱ仯����0.2mol��2L��0.1mol/L����ǰ2 min����X��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ0.1mol/L��2min��0.05mol��L��1��min��1����С���Ϊ��0.05mol��L��1��min��1��
��2����c(Z)=0.05n mol/2L =0.025n mol��L��1
v(Z)=��c/��t=0.025n mol��L��1��2min =0.05mol��L��1��min-1
���n=4
2minĩʱY��Ũ��Ϊ=0.35mol/2L=0.175 mol��L��1
��3��pH=10 ʱ�� c(H + )=10 -10 mol/L c(OH �� ) =10 -4 mol/L
pH=13 ʱ�� C(H + )=10 -13 mol/L c(OH �� ) =10 -1 mol/L
pH=12ʱ�� c(H + )=10 -12 mol/L c(OH �� ) =10 -2 mol/L
10 -4 ��n + 10 -1 ��m = (n+m) ��10 -2
n ��m = 100 ��11����С���Ϊ��100��11



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A.ԭ���������2�����ӵ�Ԫ��һ���ǵڢ�A��Ԫ��
B.ԭ�������3�����ӵ�Ԫ��һ���ǵڢ�A��Ԫ��
C.�ڻ��������ԣ�1�۵�Ԫ��һ��λ�ڵڢ�A��
D.������3�����Ӳ�����Ӷ�Ӧ��Ԫ��һ��λ�ڵ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ���һ���֣������Ԫ�آ٣����ڱ��е�λ�ã�����ѧ�����ش��������⣺
�� ���� | IA | 0 | ||||||
1 | �� | ��A | ��A | ��A | ��A | ��A | ��A | |
2 | �� | �� | �� | �� | ||||
3 | �� | �� | �� | �� | ||||
(1)ԭ�Ӱ뾶��С��Ԫ����____����Ԫ�����ƣ���д�����ԭ�ӽṹʾ��ͼ______��
(2)����������Ӧ��ˮ�����У�������ǿ����___���û�ѧʽ�ش���ͬ����������ǿ����___��
(3)������γɵĻ������У���ѧ������Ϊ_____��
(4)������γɵĻ�����ĵ���ʽΪ___��������γɵ�ԭ�Ӹ�����Ϊ1:2�Ļ�����ĽṹʽΪ____��
(5)�ۡ��ܡ���ԭ�Ӱ뾶�ɴ�С��˳��Ϊ_____����Ԫ�ط��Żش𣩡�
(6)Ϊ̽��Ԫ�آں͢�ķǽ�����ǿ����ijͬѧ�������ͼ��ʾ��װ�ý���ʵ�飨�г���������ȥ��װ�����������ã�����ش�
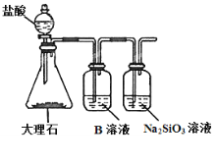
a.��ҺB��������_______
b.������____������֤������_______���û�ѧʽ�ش𣩣���ǽ�����_______����Ԫ�ط��Żش𣩡�
c.����ʵ���У���˵���ں͢�ǽ�����ǿ���Ļ�ѧ����ʽ��_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ԭ��HSO3>I��������IO3> I2���ں�3 mol NaHSO3����Һ����μ���KIO3��Һ������KIO3������I2�����ʵ����Ĺ�ϵ��������ͼ��ʾ������˵������ȷ����
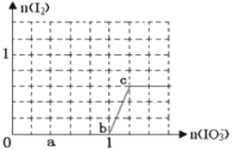
A. 0--b ��3HSO3��+ IO3���� 3SO4����+ I��+ 3H��
B. a��ʱ����NaHSO3�����ʵ���Ϊ1��2 mol
C. b��ʱ�Ļ�ԭ���������KI��NaI��b~c��Ļ�ԭ������I2
D. ����Һ��I��I2�����ʵ���֮��Ϊ5��2ʱ�������KIO3Ϊ1��8mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaNO2��һ��ʳƷ���Ӽ��������°������� KMnO4��Һ�� NaNO2���ķ�Ӧ����ʽ��MnO4-+NO2-+����Mn2++NO3-+H2O��������������ȷ����( )
A. �÷�Ӧ�� NO2-����ԭ B. ��Ӧ��������Һ��pH ��С
C. ����1 mol NaNO3������ 0.4mol KMnO4 D. ��������� OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���к��ȵIJⶨ�Ǹ�����Ҫ�Ķ���ʵ�顣ȡ0.55mol/L��NaOH��Һ50mL��0.25mol/L������50mL����ͼ��ʾ��װ���н����к��ȵIJⶨʵ�飬�ش��������⣺
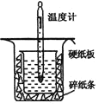
��1������ͼʵ��װ�ÿ���������ȱ�ٵ�һ�ֲ�����Ʒ��______��
��2��Ϊ��֤��ʵ��ɹ���ͬѧ��ȡ�������ʩ����ͼ����ֽ��������________��
��3��������60mL0.25mol��L-1H2SO4��50mL0.55mol��L-1NaOH��Һ���з�Ӧ������ʵ����ȣ����ų�������________��������������������������
��4��50mL0.55mol/L NaOH��Һ��50mL0.25mol/L������Һ��ʵ���������±���
����д�±��еĿհף�______
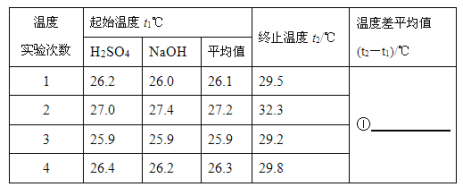
�ڽ�����Ϊ50mL0.55mol/LNaOH��Һ��50mL0.25 mol/L������Һ���ܶȶ���1g/cm3���кͺ�������Һ�ı�����c��4.18J/(g����)�����к�����H��______kJ/mol(ȡС�����һλ)��
������ʵ����ֵ�����57.3kJ/mol��ƫ�����ƫ���ԭ�������______��
a��ʵ��װ�ñ��£�����Ч����
b����ȡNaOH��Һ�����ʱ���Ӷ���
c���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
d�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩ������ġ���������Ĺؼ����������ϩij������X�������Ʊ��������ϣ���ṹ��ͼ��ʾ��3�������ڿռ��ϻ�Ϊ120��нǡ������й�X��˵����ȷ���ǣ� ��
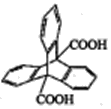
A. ����ʽΪC22H13O4 B. 1mol��������H2�ӳɿ�����11mol H2
C. �����ϵ�һ�ȴ�����3�� D. ��������������20��ԭ��λ��ͬһƽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС���ڼ������������ö���������Ũ���ᷴӦ����ȡ���ռ�������
(1)��Ҫ��ȡ���������������Ӧʹ��������ͨ��װ��_______��_____��ϴ��ƿ��
(2)ʵ����������MnO2�����ù���KMnO4���棬�������з�Ӧ��2KMnO4+16HCl(Ũ)=2MnCl2+2KCl+5Cl2��+8H2O�����ѡ������巢��װ���ǣ�����ţ�___________��
a�� b��
b�� c��
c��
(3)ijͬѧ������MnO2��KCl��ĩ����ˣ�����û����ķ����Ͳ������£��벹������������ʢ�л�Ϸ�ĩ���ձ��м���������ˮ�ܽ⣻Ȼ��____��ϴ�ӡ���������õ�MnO2��������Һ��________�����õ�KCl���塣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ʳ������Ӫ���ص�˵���������(����)
A.����ֻ�ṩ����
B.�߲���ijЩά���ء����κ���ʳ��ά����Ҫ��Դ
C.��֬��Ҫ�ṩ֬�����ر��DZ����֬����
D.�㡢Ϻ�������̵����ṩ���ʵ�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com