
【题目】已知:还原性HSO3>I,氧化性IO3> I2。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法不正确的是
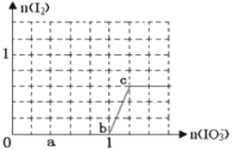
A. 0--b :3HSO3-+ IO3-= 3SO42-+ I-+ 3H+
B. a点时消耗NaHSO3的物质的量为1.2 mol
C. b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2
D. 当溶液中I与I2的物质的量之比为5∶2时,加入的KIO3为1.8mol
【答案】D
【解析】
试题根据图像可知,o-b阶段没有单质碘生成,因此反应的离子方程式是3HSO3-+ IO3-= 3SO42-+ I-+ 3H+,A正确;亚硫酸氢钠总计是3mol,所以d点对应的亚硫酸氢钠是3mol÷5×2=1.2mol,B正确;根据氧化性可知,IO3-能氧化I-生成单质碘,所以选项C正确;b点碘酸钾的物质的量是1mol,生成碘离子也是1mol。根据反应式IO3-+5I-+6H+=3I2+3H2O可知,如果设此时消耗碘离子的物质的量是x,则消耗碘酸钾就是x/5,生成单质碘是3x/5,所以有(1-x)︰3x/5=5∶2,解得x=0.4,所以加入的的碘酸钾是1+x/5=1.08mol,选项D不正确,答案选D。


科目:高中化学 来源: 题型:
【题目】用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是
A.c(OH-)/c(NH3·H2O)B.c(NH3·H2O)/c(OH-)
C.n(OH-)D.c(H﹢)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁的电化学腐蚀原理如图所示,下列有关说法中错误的是( )
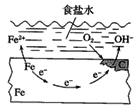
A. 铁片里的铁和碳与食盐水形成无数的微小原电池
B. 铁电极发生氧化反应
C. 负极的电极反应方程式为O2+4e-+2H2O=4OH-
D. 放置一段时间后,铁片上有铁锈出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的氢气在一定条件下完全燃烧生成气态水,放出热量值为Q1,等量的H2在同样条件下完全燃烧生成液态水,放出热量值为Q2,则Q1与Q2的关系为
A. Q1>Q2 B. Q1=Q2 C. Q1<Q2 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度时,在2 L容器中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。由此分析,该反应的化学方程_____________________________________;从反应开始至2 min,Z的反应速率为_____ mol·L-1·min-1。
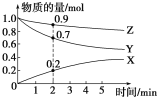
(2)若上述反应的△H<0,下列有关该反应速率的叙述,正确的是_________。
A.升高温度和增大压强均可以增大活化分子百分数,加快反应速率
B.使用催化剂可以使反应的活化能降低,加快反应速率
C.活化分子间所发生的碰撞为有效碰撞
D.降低温度,v正、v逆均减小且v正减小的倍数小于v逆减小的倍数
(3)在一密闭容器中发生反应N2(g)+3H2(g)![]() 2NH3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。 t1、t3、t4时刻分别改变的一个条件是:
2NH3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。 t1、t3、t4时刻分别改变的一个条件是:
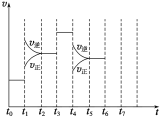
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加催化剂 F.充入氦气
t1时刻________;t3时刻________;t4时刻________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在“H2A-HA--A2-”的水溶液体系中,H2A、HA-和A2-三者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法不正确的是( )
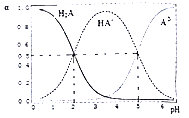
A. Ka1(H2A)=10-2、Ka2(H2A)=10-5
B. pH=6时,c(HA-)∶c(A2-)=1∶10
C. NaHA溶液中,HA-的水解能力小于HA-的电离能力
D. 在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),则α(H2A)和α(HA-)一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.4mol X气体和0.6mol Y气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)═nZ(g)+6W(g)。2min时生成0.3mol W,此时测知以Z的浓度变化表示的反应速率为0.05molL﹣1min﹣1。
试计算:
(1)前2min内用X的浓度变化表示的平均反应速率为多少?____
(2)计算n值和2min末时Y的浓度(写出必要的计算过程)。______
(3)室温下将n体积pH=10和m体积pH=13两种NaOH溶液混合得pH=12的NaOH溶液,则n:m=________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 0.5 mol Cu与足量的S反应转移电子数为![]()
B. 在粗铜精炼的实验中,阳极质量减小6.4g,则电解过程中转移电子数为0.2![]()
C. 2 g D2O和H218O的混合物中含有的中子数为![]()
D. 46 g 有机物C2H6O中含有极性共价键的数目一定为7![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素下列说法不正确的是( )
![]()
A. Y的最高价氧化物对应水化物的酸性比X的弱
B. Z位于元素周期表中第二周期,第ⅥA族
C. X的气态氢化物的稳定性比Z的弱
D. M的原子半径比Y的原子半径大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com