
根据化学反应方程式:I2+SO2+2H2O=H2SO4+2HI、2FeCl2+Cl2=2FeCl3、2FeCl3+2HI=2FeCl2+2HCl+I2,判断有关物质的还原性顺序正确的是
A.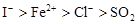 B.
B.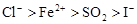
C.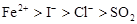 D.
D.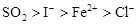
D
【解析】
试题分析:在氧化还原反应中,还原剂的还原性强于还原产物的,所以根据反应I2+SO2+2H2O=H2SO4+2HI可知,还原性是SO2>I-;同样根据反应2FeCl2+Cl2=2FeCl3可知,还原性是Fe2+>Cl-;根据反应2FeCl3+2HI=2FeCl2+2HCl+I2可知,还原性是I->Fe2+,所以微粒的还原性强弱顺序是SO2>I->Fe2+>Cl-,答案选D。
考点:考查氧化还原反应中还原性强弱的判断
点评:该题是基础性试题的考查,也是高考中的常见考点,难度不大。学生一方面需要知道判断的依据,而最更重要的是准确判断出还原剂和还原产物,有利于培养学生的灵活运用基础知识的能力。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| V |
| Vm |
| V |
| Vm |
| n |
| V |
| n |
| V |
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学将标准状况下44.8L的HCl气体溶于水,配成500mL的溶液,并取出100mL该盐酸溶液与2mol/L的Ba(OH)2 溶液进行中和反应。
(1)根据公式 ,可知该HCl气体的物质的量为________。
(2)根据公式 ,可知所配成的盐酸溶液的物质的量浓度为 。
(3)100mL盐酸溶液中含HCl的物质的量为 ,
(4)根据化学反应方程式 ,可知反应过程中n[Ba(OH)2]: n(HCl) = ,所以n[Ba(OH)2]为 mol,因此,反应所消耗的的体积Ba(OH)2为 。
查看答案和解析>>
科目:高中化学 来源:2010年广东省东莞市五校联考高一上学期期中考试化学卷 题型:填空题
某同学将标准状况下44.8L的HCl气体溶于水,配成500mL的溶液,并取出100mL该盐酸溶液与2mol/L的Ba(OH)2溶液进行中和反应。
(1)根据公式 ,可知该HCl气体的物质的量为________。
(2)根据公式 ,可知所配成的盐酸溶液的物质的量浓度为 。
(3)100mL盐酸溶液中含HCl的物质的量为 ,
(4)根据化学反应方程式 ,可知反应过程中n[Ba(OH)2]: n(HCl) = ,所以n[Ba(OH)2]为 mol,因此,反应所消耗的的体积Ba(OH)2为 。
查看答案和解析>>
科目:高中化学 来源:2010年广东省东莞市五校联考高一上学期期中考试化学卷 题型:填空题
某同学将标准状况下44.8L的HCl气体溶于水,配成500mL的溶液,并取出100mL该盐酸溶液与2mol/L的Ba(OH)2 溶液进行中和反应。
(1)根据公式 ,可知该HCl气体的物质的量为________。
(2)根据公式 ,可知所配成的盐酸溶液的物质的量浓度为 。
(3)100mL盐酸溶液中含HCl的物质的量为 ,
(4)根据化学反应方程式 ,可知反应过程中n[Ba(OH)2]: n(HCl) = ,所以n[Ba(OH)2]为 mol,因此,反应所消耗的的体积Ba(OH)2为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com