
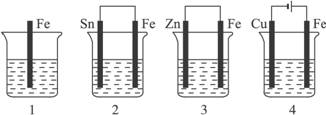
图4-20
A.4>2>1>3 B.2>1>3>4 C.4>2>3>1 D.3>2>4>1
 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:




| ||
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:

| 时间/min | CH4(mol) | H2O(mol) | CO(mol) | H2(mol) |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | x1 | 0.80 | x2 | 0.60 |
| 7 | 0.20 | y1 | 0.20 | y2 |
| 10 | 0.21 | 0.81 | 0.19 | 0.64 |
查看答案和解析>>
科目:高中化学 来源: 题型:
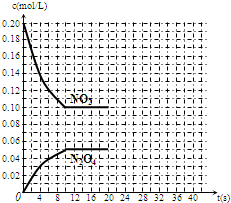 在30℃时,将0.40mol的二氧化氮气体充入2L抽空的密闭容器中,经过10s达到平衡,浓度变化曲线如图所示,试回答:
在30℃时,将0.40mol的二氧化氮气体充入2L抽空的密闭容器中,经过10s达到平衡,浓度变化曲线如图所示,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
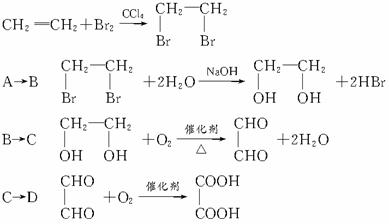
图1-4-20
请完成下列各题:
(1)写出结构简式:A_________,F_________,C_________。
(2)反应类型:X_________、Y_________。
(3)写出化学反应方程式:
A→B____________________________________;
G→H____________________________________。
(4)若环状酯E在NaOH溶液中共热,则发生反应的化学方程式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com