
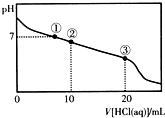
 常温下,向20.00mL 0.100mol/L CH3COONa溶液中逐滴加入0.1 000mol/L盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发).下列说法正确的是( )
常温下,向20.00mL 0.100mol/L CH3COONa溶液中逐滴加入0.1 000mol/L盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发).下列说法正确的是( )

科目:高中化学 来源:吉林省长春外国语学校2008-2009学年上学期高三期中考试(化学) 题型:013
|
常温下,向20 L真空容器中通入a mol H2S和b mol Cl2(a、b均为正整数,且a≤5,b≤5),反应完成后,容器内气体可能达到的最大密度是 | |
| [ ] | |
A. |
17.85 g·L-1 |
B. |
18.00 g·L-1 |
C. |
18.25 g·L-1 |
D. |
18.50 g·L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省扬州、南通、泰州、宿迁四市高三第二次调研测试化学试卷(解析版) 题型:选择题
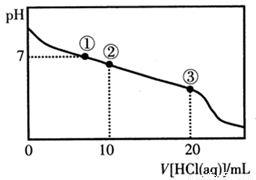
常温下,向20.00 mL 0.100 mol/LCH3COONa溶液中逐滴加入0.1 000 mol/L盐酸,溶液的pH与所加盐酸体积的关系如右下图所示(不考虑挥发)。下列说法正确的是

查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省扬州市高三下学期5月考前适应性考试化学试卷(解析版) 题型:选择题
常温下,向20.00 mL 0.1000 mol·L—1 (NH4)2SO4溶液中逐滴加入0.2000 mol·L—1NaOH时,溶液的pH与所加NaOH溶液体积的关系如右下图所示(不考虑挥发)。下列说法正确的是
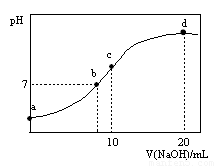
A.点a所示溶液中:c(NH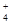 )>c(SO
)>c(SO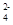 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B.点b所示溶液中:c(NH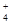 )=c(Na+)>c(H+)=c(OH-)
)=c(Na+)>c(H+)=c(OH-)
C.点c所示溶液中:c(SO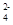 )+ c(H+)= c(NH3·H2O )+ c(OH-)
)+ c(H+)= c(NH3·H2O )+ c(OH-)
D.点d所示溶液中:c(SO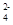 )>c(NH3·H2O )>c(OH-)>c(NH
)>c(NH3·H2O )>c(OH-)>c(NH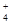 )
)
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com