
科目:高中化学 来源: 题型:
下表中物质的分类组合完全正确的是( )
|
查看答案和解析>>
科目:高中化学 来源: 题型:
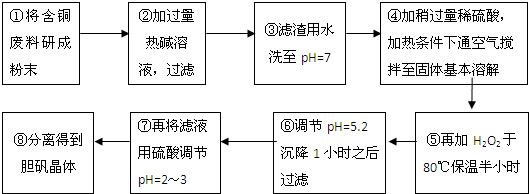
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
| pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
查看答案和解析>>
科目:高中化学 来源:学习周报 化学 人教课标高一版(必修1) 2009-2010学年 第13期 总第169期 人教课标版 题型:013
|
取少量 MgO、Al2O3、CuO、Fe2O3的混合粉末,加入过量盐酸,充分反应后得到滤液Y.下列叙述正确的是 | |
| [ ] | |
A. |
上述四种氧化物中,有两种是两性氧化物 |
B. |
滤液 Y为无色透明的溶液 |
C. |
滤液 Y中的阳离子主要是Mg2+、Al3+、Fe3+、Cu2+、H+ |
D. |
向滤液 Y中加入过量氢氧化钠,所得沉淀为Fe(OH)3和Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com