
【题目】表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
(1)画出⑧的元素原子结构示意图__________。
(2)表中非金属性最强的元素阴离子与④的离子半径大小关系为(用离子符号表示)__________。元素④和⑩形成的化合物为__________化合物(填“离子”或“共价”)
(3)表中某元素能形成两性氢氧化物,该氢氧化物与⑨最高价氧化物的水化物反应的离子方程式为_________________________________。
(4)元素⑦的非金属性强于⑥,写出支持该结论的一个化学方程式__________________
(5)请设计一个实验方案,比较③、④元素的单质还原性的强弱,写出实验操作步骤、现象及结论:______________________________________________________________________________________________________________________________________________________。
(6)下表中的数据是破坏(或形成)1 mol物质中的化学键所吸收(或释放)的能量(kJ)。这一数据的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热,回答下列问题:
化学键 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
反应Br2 + H2=2HBr,当生成2 mol HBr时放出_____________ kJ能量。
【答案】 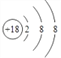 F- > Al3+ 共价 Al(OH)3+OH— == [Al(OH)4]— H2S+Cl2=2HCl+S 方法一:将相同大小相同表面积的镁片和铝片分别投入到沸水(或相同浓度的盐酸溶液中)中,观察实验现象,若镁条与沸水(或相同浓度盐酸)反应剧烈,则证明③比④单质还原性强。方法二:将相同大小相同表面积的镁片和铝片投入到沸水,向反应后的溶液中各滴加几滴无色酚酞溶液,若镁条与沸水反应后溶液变红,铝条与沸水反应后溶液不变色,则证明③比④单质还原性强 103
F- > Al3+ 共价 Al(OH)3+OH— == [Al(OH)4]— H2S+Cl2=2HCl+S 方法一:将相同大小相同表面积的镁片和铝片分别投入到沸水(或相同浓度的盐酸溶液中)中,观察实验现象,若镁条与沸水(或相同浓度盐酸)反应剧烈,则证明③比④单质还原性强。方法二:将相同大小相同表面积的镁片和铝片投入到沸水,向反应后的溶液中各滴加几滴无色酚酞溶液,若镁条与沸水反应后溶液变红,铝条与沸水反应后溶液不变色,则证明③比④单质还原性强 103
【解析】根据元素在周期表中的相对位置可知①~⑩分别是N、F、Mg、Al、Si、S、Cl、Ar、K、Br。则
(1)Ar的原子序数是18,元素原子结构示意图为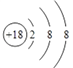 。(2)氟离子和铝离子的核外电子排布相同,离子半径随原子序数的增大而减小,则离子半径大小关系为F- >Al3+。元素④和⑩形成的化合物为溴化铝,由于氯元素非金属性强于溴元素,而氯化铝是共价化合物,则溴化铝属于共价化合物;(3)表中某元素能形成两性氢氧化物是Al,该氢氧化物与⑨最高价氧化物的水化物KOH反应的离子方程式为Al(OH)3+OH- == [Al(OH)4]-。(4)氯气能把H2S氧化为单质S,说明元素⑦的非金属性强于⑥,反应的化学方程式为H2S+Cl2=2HCl+S;(5)金属性越强,与水或酸反应的越剧烈,则比较③、④元素的单质还原性的强弱的实验操作步骤、现象及结论为:将相同大小相同表面积的镁片和铝片分别投入到沸水(或相同浓度的盐酸溶液中)中,观察实验现象,若镁条与沸水(或相同浓度盐酸)反应剧烈,则证明③比④单质还原性强;(6)反应热等于断键吸收的能量和形成化学键所放出的能量的差值,则反应Br2 + H2=2HBr的焓变是(193+436-2×366)kJ/mol=-103kJ/mol,所以当生成2 mol HBr时放出103 kJ能量。
。(2)氟离子和铝离子的核外电子排布相同,离子半径随原子序数的增大而减小,则离子半径大小关系为F- >Al3+。元素④和⑩形成的化合物为溴化铝,由于氯元素非金属性强于溴元素,而氯化铝是共价化合物,则溴化铝属于共价化合物;(3)表中某元素能形成两性氢氧化物是Al,该氢氧化物与⑨最高价氧化物的水化物KOH反应的离子方程式为Al(OH)3+OH- == [Al(OH)4]-。(4)氯气能把H2S氧化为单质S,说明元素⑦的非金属性强于⑥,反应的化学方程式为H2S+Cl2=2HCl+S;(5)金属性越强,与水或酸反应的越剧烈,则比较③、④元素的单质还原性的强弱的实验操作步骤、现象及结论为:将相同大小相同表面积的镁片和铝片分别投入到沸水(或相同浓度的盐酸溶液中)中,观察实验现象,若镁条与沸水(或相同浓度盐酸)反应剧烈,则证明③比④单质还原性强;(6)反应热等于断键吸收的能量和形成化学键所放出的能量的差值,则反应Br2 + H2=2HBr的焓变是(193+436-2×366)kJ/mol=-103kJ/mol,所以当生成2 mol HBr时放出103 kJ能量。


科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写与所给条件不相符的是
A.将Cl2通入氢氧化钠溶液制取漂白液:Cl2+2OH![]() Cl+ClO+H2O
Cl+ClO+H2O
B.已知亚硫酸(H2SO3)的二级电离常数K2比偏铝酸(HAlO2)的电离常数K要大,则将少量的SO2气体通入到偏铝酸钠溶液中发生的离子反应是:2![]() +SO2+3H2O
+SO2+3H2O![]() 2Al(OH)3↓+
2Al(OH)3↓+![]()
C.在明矾溶液中加入氢氧化钡溶液至沉淀的质量达到最大时发生的离子反应是:2Al3++3![]() +3Ba2++6OH
+3Ba2++6OH![]() 3BaSO4↓+2Al(OH)3↓
3BaSO4↓+2Al(OH)3↓
D.利用酸性高锰酸钾测居室中甲醛含量反应为:4![]() + 5HCHO +12H+
+ 5HCHO +12H+![]() 4Mn2+ + 5CO2↑+11H2O
4Mn2+ + 5CO2↑+11H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 非金属单质中一定存在共价键
B. 金属元素和非金属元素形成的化合物一定是离子化合物
C. 含共价键的化合物不一定是共价化合物
D. 溶于水能导电的化合物就是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。

(1)写出下列仪器的名称①___________;
(2)仪器①~④中,使用时必须检查是否漏水的 有___________。(填序号)
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器有__________,现需配制250 ml 0.2 mol/L NaCl溶液,装置II是某同学转移溶液的示意图,图中的错误是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中正确的是( )
A. 蒸馏操作时,温度计水银球靠近蒸馏烧瓶的底部,且向蒸馏液体中加入几块沸石,以防止暴沸
B. 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
C. 焰色反应每次实验都要先用稀硫酸洗净铂丝
D. 过滤、结晶、萃取、分液和蒸馏等都是常用的分离混合物的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A. NH3易液化,液氨常用作制冷剂
B. 与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3
C. 铵盐受热易分解,因此贮存铵态氮肥时要密封保存,并放在阴凉通风处
D. 稀HNO3和活泼金属反应时得不到氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料.工业上提取氧化铝的工艺流程如下:

(1)沉淀A的成分是(填化学式)_________。
(2) 步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH﹣=H2O还有:
_____________________________、________________________________;
(3) 步骤③中通入过量CO2气体而不加入过量盐酸的理由是___________________;
(4) 准确称取8g铝土矿样品,加入一定量试剂a的溶液,使其中的Al2O3、Fe2O3恰好溶解;然后,向滤液中加入10mol·L-1的NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,则样品中Al2O3的百分含量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为0.100mol/LNaOH溶液分别滴定20.00mL0.100mol/L的HA和HB的滴定曲线。下列说法错误的是(己知1g2≈0.3)

A. HB是弱酸,b点时溶液中c(B-)>c(Na+)>c(HB)
B. a、b、c三点水电离出的c(H+): a<b<c
C. 滴定HB时,不宜用甲基橙作指示剂
D. 滴定HA溶液时,当V(NaOH)=19.98mL时溶液pH约为3.7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com