
| 1 |
| 2 |
| n |
| V |
| 0.04mol |
| 0.05L |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
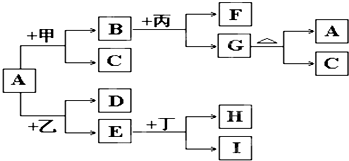
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�����ʽ����½̰��������л�ѧ�����꼶���ڶ��ᣨ�ϲᣩ ���ͣ�021
����Fe��FeO��Fe2O3��ɵĻ�����м���100 mL 2 mol/L�����ᣬǡ��ʹ�������ȫ�ܽ⣬���ų�448 mL����(��״��)����ʱ��Һ����Fe3+���������ж���ȷ����
[����]
A����������������ʷ�Ӧʱ������������ʵ���֮��Ϊ1��1��3
B����Ӧ��������Һ�е�Fe2+��Cl�������ʵ���֮��Ϊ1��2
C��������FeO�����ʵ�����ȷ������Fe��Fe2O3�����ʵ�����
D��������Fe2O3�����ʵ�����ȷ������Fe��FeO�����ʵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A.1��1 B.2��5
C.4��1 D.3��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����FeO��Fe��Fe2O3 ��ɵĻ�����м���100mL2mol/L�����ᣬǡ��ʹ�������ȫ�ܽ⣬���ų�448mL���壨���������ʱ��Һ����Fe3+���������ж���ȷ����
A. ��������������ʷ�Ӧʱ������������ʵ���֮��Ϊ1��1��3
B. ��Ӧ��������Һ�е�Fe2+��Cl-���ʵ���֮��Ϊ1��2
C. ������FeO�����ʵ�����ȷ������Fe��Fe2O3�����ʵ�����
D. ������Fe2O3�����ʵ�����ȷ������Fe��FeO�����ʵ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com