
| A. | 将4.6 g金属钠放入95.4 g蒸馏水中,可得到溶质质量分数为8%的溶液 | |
| B. | 金属钠与水的反应实质上是与水电离产生的H+反应 | |
| C. | 将金属钠投入饱和NaCl溶液中,会有晶体析出,钠的性质活泼,故应保存在CCl4中 | |
| D. | 做有关钠的性质实验时,剩余的Na不用放回原试剂瓶 |
分析 A、钠与水反应生成氢氧化钠和氢气,溶质为氢氧化钠,溶液的质量等于钠的质量加水的质量减去氢气的质量;
B、钠能与水反应生成氢氧化钠和氢气;
C、金属钠投入饱和NaCl溶液中与水反应消耗水,则有氯化钠晶体析出,但钠的性质活泼,故应保存在煤油中;
D、剩余的Na应该放回原试剂瓶.
解答 解:A.钠与水反应:
2Na+2H2O═2NaOH+H2↑
46 80 2
4.6g m(NaOH) m(H2) 解得:m(NaOH)=8g;m(H2)=0.2g;
溶液的溶质的质量分数:$\frac{8g}{4.6g+95.4g-0.2g}$×100%>8%,故A错误;
B.钠能与水反应生成氢氧化钠和氢气,实质是金属钠和水电离出的氢离子之间的反应,故B正确;
C.金属钠投入饱和NaCl溶液中与水反应消耗水,则有氯化钠晶体析出,但钠密度比四氯化碳小,所以应保存在煤油中,故C错误;
D.因钠易燃烧而导致实验事故,使用剩下的金属钠仍放回原瓶,故D错误.
故选B.
点评 本题考查了钠的性质以及溶液中溶质的质量分数计算,明确发生的化学反应,准确判断溶质和溶液的质量是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锗可用于制造半导体材料 | |
| B. | RbOH的碱性强于Ca(OH)2 | |
| C. | SrCO3是白色难溶于水易溶于盐酸的化合物 | |
| D. | 砹化银(AgAt)是白色难容于稀硝酸的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  根据图可判断可逆反应 A2(g)+3B2 (g)?3C(g)+D(s) 的△H>0 | |
| B. |  图表示压强对可逆反应2A (g)+2B (g)?2AB3 (g)的影响,乙的压强大 | |
| C. |  图可以表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| D. |  图④是N2与H2合成氨的能量变化曲线,可确定该反应1 molN2和4mol H2充分反应时放热一定小于92kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,32克 O2与O3所含的原子数目相同,均为NA | |
| B. | 46克的NO2和N2O4混合气体中含原子数目为3 NA | |
| C. | 18克的NH4+中含有电子数为NA | |
| D. | 28 g Fe变为离子时,失去的电子数一定为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种元素组成的分子中所含化学键一定都是极性键 | |
| B. | 金属晶体的熔点一定比分子晶体的高 | |
| C. | 某晶体中含有阳离子,则一定也含有阴离子 | |
| D. | 含有阴离子的化合物一定含有阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
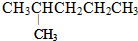 的是( )
的是( )| A. | CH3CH=CHCHCH2CH3 | B. | CH2=CHCHCH2CH3 | ||
| C. | CH≡CCHCH2CH3 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com