
【题目】某元素原子L层电子数是K层电子数的2倍,那么此元素是( )
A.FB.CC.OD.N
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】下列各物质所含原子数目,按由大到小顺序排列的是( )
①0.5 mol NH3②标准状况下22.4 L He ③4 ℃ 9 mL水 ④19.6 g H3PO4
A. ①④③② B. ④③②①
C. ②③④① D. ①④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法正确的是( )
A.厨房中用的食盐、食醋都是电解质
B.95%的医用酒精溶液可用于环境消毒
C.硅胶和生石灰均可用作食品包装袋内的干燥剂
D.石英玻璃、普通玻璃、钢化玻璃都属于硅酸盐产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环已酮是工业上的一种重要有机合成原料和溶剂.实验室制备原理为: ,其反应的装置示意图如下(夹持装置加热装置略去):
,其反应的装置示意图如下(夹持装置加热装置略去):
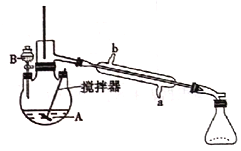
已知:
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8) | 0.962 | 能溶于水 |
环已酮 | 155.6(95) | 0.948 | 微溶于水 |
(注:括号中的数据表示该有机物与水形成的具有固定组成的恒沸物的沸点)
(1)制备产品。通过仪器B____(填仪器名称)将酸性Na2Cr2O7和H2SO4混合溶被加到盛有环已醇的三颈烧瓶A中,通过______(填序号)方法加热到55-60℃进行反应。
a.酒精灯加热 b.油浴加热 c.水浴加热
(2)分离粗品。反应完成后,加入适量水,蒸馏,收集95-100℃的馏分(主要含环已酮粗品和水的混合物),试解释无法分离环己酮和水的原因是____________。
(3)提纯环已酮。
①在收集到的粗品中加NaCl固体至饱和,静置,分液。加入NaCl固体的作用是________。
②加入无水MgSO4固体,除去有机物中________ (填物质名称)。
③过滤,蒸馏,收集151-156℃馏分,得到精品。
(4)下列关于实验的叙述中,错误的是________。
A.冷凝管的冷水应该从b进从a出
B.实验开始时,温度计水银球应插入反应液中,便于控制反应液的温度
C.装置B中也可加入Na2Cr2O7和稀盐酸混合溶液
D.反应过程中,需不断搅拌
(5)利用环已酮做萃取剂可分离含Co2+、Mn2+的溶液,根据下图信息可判断,将pH范围控制在_______左右时可分离出Mn2+。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是
A. 用排饱和氯化钠溶液的方法来收集氯气
B. 配制和保存硫酸铁溶液常加入适量稀硫酸
C. 向氢氧化镁悬浊液中加入饱和氯化铵溶液,溶液变澄清
D. 对2 HI (g)![]() H2 (g) + I2 (g)的平衡体系,增大压强使颜色变深
H2 (g) + I2 (g)的平衡体系,增大压强使颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与胶体性质无关的是( )
A.向豆浆中加入硫酸钙做豆腐
B.将植物油倒入水中用力搅拌形成油水混合物
C.利用丁达尔效应可以区别溶液与胶体
D.观看电影时,从放映机到银幕有明显的光路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物是我们熟悉的典型非金属元素,研究它们的性质对于生产、生活、科研具有重要意义,请回答以下问题:
I.(1)图为制取氨气的装置和选用的试剂,其中错误的是______.(填字母)
A.①② B.②③ C.③④ D.①③

(2)实验室制备氨气的化学反应方程式是_______________________________________为了得到干燥的 NH3,可用_______做干燥剂。若有5.35g氯化铵参加反应,则产生的气体在标准状况下的体积为______L.
II.铵盐受热易分解,如图所示

(1)被加热的铂丝处发生反应的化学方程式为_______________________________.
(2)B中出现的现象为___________________________.
(3)烧杯C中发生反应可得到酸X,如图:足量X的浓溶液与Cu反应,写出烧瓶中发生反应的离子方程式______________________.

(4)实验完毕后,试管中收集到的气体的主要成分为______(写化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮的氧化物、碳的氧化物等大气污染物的处理具有重要意义。
I. 已知:①N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1 ②CO的燃烧热△H= - 283 kJ·mol-1
(1)汽车排气管内安装的催化转化器,可使尾气中主要污染物(NO和CO)转化为无毒的大气循环物质,该反应的热化学方程式为_________________________________________________。
(2)一定温度下,在恒容密闭容器中充入1 molNO和2 molCO进行该反应,下列能判断反应达到化学平衡状态的是_______。
①单位时间内消耗a mo1 CO的同时生成2a mol NO
②混合气体的平均相对分子质量不再改变
③混合气体中NO和CO的物质的量之比保持不变
④混合气体的密度不再改变
II. 臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表:
N2O5(g)+O2(g),向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表:
t/s | 0 | 3 | 6 | 12 | 24 | 36 |
甲容器(T1)n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 | 0.80 |
乙容器(T2)n(O2)/mol | 0 | 0.30 | 0.50 | 0.70 | 0.85 | 0.85 |
(3)T1___T2(填>、<或=,下同),该反应ΔH___0 。简述理由________________________________。
(4)甲容器中,0~3s内的平均反应速率v(NO2)=______________________。
(5)甲容器中NO2平衡转化率为________,T1时该反应的平衡常数为_______________________。
III. 将NO2(g)转化为N2O4(g)

(6)石墨I为______极(选填正、负),Y化学式为_________。
(7)II电极反应式为_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com