
【题目】苯与乙烯相比较,下列叙述不正确的是
A. 都能在空气中燃烧
B. 都容易发生取代反应
C. 苯和乙烯都能在一定条件下发生加成反应
D. 苯不能使酸性KMnO4溶液褪色而乙烯能
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】一般较强酸可制取较弱酸,这是复分解反应的规律之一。
已知在常温下:K(C6H5OH)=1.2×10-10 K(CH3COOH)=1.8×10-5
K(H2CO3)=4.3×10-7 K(HCO3-)=5.6×10-11 K(HCN)=4.9×10-10
(1)请根据上述信息求Na2CO3+C6H5OH![]() NaHCO3+C6H5ONa的化学平衡常数K=_________;
NaHCO3+C6H5ONa的化学平衡常数K=_________;
(2)常温下某电解质溶解在水中后,溶液中的c(H+)=10-9molL-1,则该电解质可能是____(填序号);
A. CuSO4
B. HCl
C. Na2S
D.NaOH
E.K2SO4
(3)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性
①浓度为1.0×l0-3mol.L-1的氨水bL;
②c(OH-)=1.0×10-3mol.L-l的氨水cL;
③c(OH-)=1.0×10-3molL-1的氢氧化钡溶液dL.
则a、b、c、d之间由大到小的关系是:_________;
(4)一定温度下,向等体积纯水中分别加入等物质的量的CH3COONa和NaCN,两溶液中阴离子的总物质的量分别为n1和n2,则n1和n2的关系为n1_______n2(填“>”、“<”或“=”);
(5)己知常温时Ksp(AgCl)=1.8×10-10mol2L-2,向50mL 0.018molL-1的AgNO3溶液中加入相同体积0.020molL-1的盐酸,则c(Ag+)=_______,此时所得混合溶液的pH=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届绵阳三诊】通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是

A.b为电池的负极,甲醛被氧化
B.a极的电极反应为O2+4e-+4H+==2H2O
C.传感器工作过程中,电解质溶液中硫酸的浓度不变
D.当电路中转移1×10-4 mol电子时,传感器内参加反应的HCHO为0.75 mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验某溶液中是否含有常见的四种无机离子,某化学小组的同学进行了如下所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得出的正确结论是( )

A.原溶液中一定含有SO42- B.原溶液中一定含有NH4+
C.原溶液中一定含有Cl- D.原溶液中一定含有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物来制备溴乙烷,并检验反应的部分副产物和探究溴乙烷的性质。已知:NaBr+H2SO4![]() NaHSO4+HBr↑
NaHSO4+HBr↑
(一)溴乙烷的制备及产物的检验:设计了下图装置,其中夹持仪器、加热仪器及冷水管没有画出。请根据实验步骤,回答下列问题:

(1)制备操作中,加入少量的水,其目的是 (填字母)。
a.减少副产物烯和醚的生成
b.减少Br2的生成
c.减少HBr的挥发
d.水是反应的催化剂
(2)检验副产物中是否含有溴化氢:熄灭酒精灯,在竖直冷凝管上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验。B、C中应盛放的试剂分别是 、 (填字母)。
a.苯 b.水 c.NaOH 溶液 d.硝酸银溶液
(3)欲除去溴乙烷中的少量杂质Br2,正确方法是 (填字母)。
a.KI溶液洗涤
b.氢氧化钠溶液洗涤
c.用四氯化碳萃取
d.用亚硫酸钠溶液洗涤
(二)溴乙烷性质的探究:某同学用下图装置(铁架台、酒精灯等未画出)来探究溴乙烷的性质。在试管中加入10 mL 6molL-1NaOH水溶液和5 mL 溴乙烷,水浴加热。当观察到___________ 现象时,表明溴乙烷与NaOH水溶液已完全反应。该反应的化学方程式为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠(Na2MoO4)具有广泛的用途.可做新型水处理荆、优良的金属缓蚀剂及可用于局部过热的循环水系统;Al(OH)3工业和医药上都具有重要用途.现从某废钼催化剂(主要成分MoO3、Al2O3、Fe2O3等)中回收Na2MoO4和Al(OH)3,其工艺如图:

回答下列问题:
(1)已知MoO3、Al2O3与SiO2相似,均能在高温下跟Na2CO3发生类似反应,试写出MoO3与Na2CO3反应的化学方程式:__________________。
(2)第②步操作所后的滤液中,溶质有Na2MoO4、_________和过量的Na2CO3;检验第②步操作所得滤渣中含有三价铁的方法是___________________。
(3)第③步操作H2SO4需要适量,通常是通过_________来调控H2SO4的用量;与Na2SO4相比,Na2MoO4的溶解度受温度的影响变化__________(填“较大”或“较小”)。
(4)利用铝热反应可回收金属钼。将所得钼酸钠溶液用酸处理得到沉淀,再加热可得MoO3。写出MoO3发生铝热反应的化学方程式:_________________。
(5)取废钼催化剂5.00g,加入5.30gNa2CO3(足量),经上述实验操作后,最终得到2.34g Al(OH)3和6.39gNa2SO4晶体,则废钼催化剂中Al2O3、MoO3的物质的量的比值为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(8分)在标准状况下,将224 L HCl气体溶于635 mL水中,所得盐酸的密度为1.18 g·cm-3。试计算:
(1)所得盐酸的质量分数和物质的量浓度分别是____________、_______________ 。
(2)取出这种盐酸100 mL,稀释至1.18 L,所得稀盐酸的物质的量浓度是___________。
(3)在40.0 mL 0.065 mol·L-1 Na2CO3溶液中,逐渐加入(2)所稀释的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过_____________mL。
(4)将不纯的NaOH样品1 g(样品含少量Na2CO3和水),放入50 mL 2 mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL 1 mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到_____克固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)实验室制取少量溴乙烷的装置如下图所示。根据题意完成下列填空: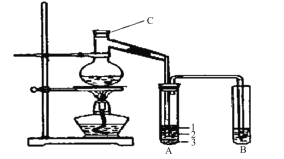
(1)装置图中C仪器的名称为 ,向C中加入的反应物是溴化钠、 和1:1的硫酸。配制体积比1:1的硫酸所用的定量仪器为 (选填编号)。
a.天平 b.量筒 c.容量瓶 d.滴定管
(2)写出加热时烧瓶中发生的主要反应的化学方程式 。
(3)将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是 。如图所示试管A中的物质分为三层,产物在第 层。
(4)试管A中除了产物和水之外,还可能存在 、 (写出化学式)。
(5)用浓的硫酸进行实验,若试管A中获得的有机物呈橙红色,除去其中杂质的最合理的方法是 (选填编号)。
a.蒸馏
b.氢氧化钠溶液洗涤
c.用四氯化碳萃取
d.用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称应该是 。
(6)实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com