
【题目】氨气和氯气是重要的工业原料,某兴趣小组设计了相关实验探究它们的某些性质。
实验一:认识喷泉实验的原理,并测定电离平衡常数K(NH3·H2O)。
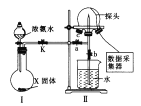
(1)使图中装置Ⅱ产生喷泉的实验操作是_____________________________________。
(2)喷泉实验结束后,发现三颈烧瓶中未充满水(假如装置的气密性良好),原因是______。用___________(填仪器名称)量取25.00 mL喷泉实验后的氨水至锥形瓶中,用0.0500 mol·L-1的盐酸测定氨水的浓度,滴定曲线如图所示。下列关于该滴定实验的说法中正确的是__________(填字母)。
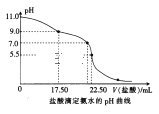
A.应选择甲基橙作为指示剂
B.当pH=7.0时,氨水与盐酸恰好中和
C.酸式滴定管未用盐酸润洗会导致测定结果偏低
D.当pH=11.0时,K(NH3·H2O)约为2.2×10-5
实验二:拟用如下装置设计实验来探究纯净、干燥的氯气与氨气的反应。
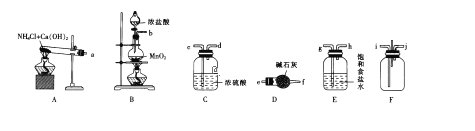
(3)A中所发生反应的化学方程式为__________________________________。
(4)上图中的装置连接顺序为①_________②_________③_________(用大写字母表示)。若按照正确顺序连接实验装置后,则整套实验装置存在的主要缺点是________。
(5)写出F装置中的反应的一种工业用途:___________________________________。
(6)反应完成后,F装置中底部有固体物质生成。请利用该固体物质设计一个实验方案证明NH3·H2O为弱碱(其余实验用品自选):___________________________________。
【答案】在三颈烧瓶中收集满氨气,关闭止水夹a,打开止水夹b,用热毛巾敷在三颈烧瓶底部 氨气中混有空气(或其他合理答案) 碱式滴定管 AD 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+H2O D E C 无尾气处理装置 用氨气检验氯气管道是否漏气 取F装置中的固体物质溶于水配成溶液,测定溶液的pH,若pH<7,可证明NH3·H2O为弱碱(或其他合理答案)
CaCl2+2NH3↑+H2O D E C 无尾气处理装置 用氨气检验氯气管道是否漏气 取F装置中的固体物质溶于水配成溶液,测定溶液的pH,若pH<7,可证明NH3·H2O为弱碱(或其他合理答案)
【解析】
(1)使装置I中产生的氨气溶于水,三颈烧瓶内形成气压差;
(2)集气时有空气混入,空气中氧气、氮气不溶于水,则三颈烧瓶未充满水;氨水溶液呈碱性;依据酸碱中和滴定原理及弱电解质电离平衡常数K(NH3H2O)=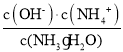 ;
;
(3)可用氯化氨与熟石灰制取氨气;
(4)装置A制取氨气,可用氯化氨与熟石灰,D装置中盛放的碱石灰,用来干燥氨气;E装置中盛放的饱和食盐水,用来除去氯气中混有的氯化氢气体;根据气体的制备、除杂、混合反应及尾气吸收的顺序安装反应装置;
(5)根据氯气与氨气反应生成氯化铵和氮气的现象可知F装置中的反应的一种工业用途;
(6)根据氯化铵溶液呈酸性可证明NH3H2O为弱碱。
(1)在三颈烧瓶中收集满氨气,关闭止水夹a,打开止水夹b,用热毛巾敷在三颈烧瓶底部,进而使装置II中三颈烧瓶内形成喷泉;
(2)氨气极易溶于水,全为氨气可充满烧瓶,若混有空气,则水不能充满;用碱式滴定管量取氨水至锥形瓶中;
A. 酸滴定碱,生成氯化铵溶液显酸性,则可用甲基橙做指示剂,A项正确;
B. NH3H2O为弱碱,若氨水与盐酸恰好中和,则溶液生成的氯化铵盐溶液显酸性,pH<7,则当pH=7.0时,氨水过量,B项错误;
C. 酸式滴定管未用盐酸润洗,由c(NH3H2O)=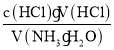 分析可知,V(HCl)大,则测定结果偏高,C项错误;
分析可知,V(HCl)大,则测定结果偏高,C项错误;
D.设氨水的物质的量浓度为c,则:c×20 mL=0.05000 mol/L×22.40 mL,解得c(NH3H2O)=0.045 mol/L,弱电解质电离平衡常数K(NH3H2O)= 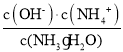 ,pH=11的氨水中c(OH)=0.001mol/L,c(OH)≈c(NH4+)=0.001 mol/L,则:K(NH3H2O)=
,pH=11的氨水中c(OH)=0.001mol/L,c(OH)≈c(NH4+)=0.001 mol/L,则:K(NH3H2O)=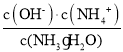 =
=![]() =2.2×105,D项正确;
=2.2×105,D项正确;
故答案为:氨气中混有空气(或其他合理答案);碱式滴定管;AD;
(3)可用装置A制取氨气,发生反应的化学方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+H2O;
CaCl2+2NH3↑+H2O;
(4)装置A制取氨气,可用氯化氨与熟石灰,D装置中盛放的碱石灰,用来干燥氨气;E装置中盛放的饱和食盐水,用来除去氯气中混有的氯化氢气体;C装置用来干燥氯气,然后在F中混合反应,则连接顺序为A→D→F、C←E←B,整套实验装置存在的主要缺点是无尾气处理装置;
(5)根据氯气与氨气反应8NH3+3Cl2=6NH4Cl+N2的现象可知F装置中的反应的一种工业用途是用氨气检验氯气管道是否漏气;
(6)根据氯化铵溶液呈酸性,设计证明NH3H2O为弱碱实验方案为:取F装置中的固体物质溶于水配成溶液,测定溶液的pH,若pH<7,可证明NH3·H2O为弱碱(或其他合理答案)。


科目:高中化学 来源: 题型:
【题目】某课外活动小组同学用下图装置进行实验,试回答下列问题:
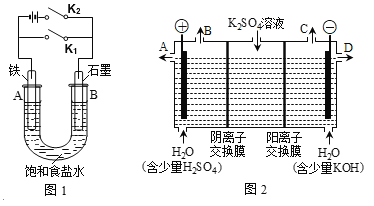
Ⅰ.以图1的实验装置进行实验。
(1)若开始时打开开关K2,闭合开关K1,则该装置为__________(填装置名称)。
(2)若开始时打开开关K1,闭合开关K2,则:
①U型管里总反应的离子方程式为____________________。
②对于上述实验,下列说法正确的是_________(填序号)。
A.溶液中Na+向B极移动
B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
D.若标准状况下从A极逸出2.24L气体,则外电路上通过的电子数目约为0.2NA
Ⅱ.以图2的实验装置进行实验。
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。
①该电解槽的阳极反应式为___________________。单位时间内通过阴离子交换膜的离子数______(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②从出口D导出的溶液是____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置能达到实验目的的是
A. 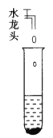 清洗铜与浓硫酸反应后有残液的试管
清洗铜与浓硫酸反应后有残液的试管
B. 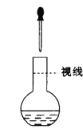 配置一定物质的量浓度的溶液实验中,为定容时的操作
配置一定物质的量浓度的溶液实验中,为定容时的操作
C. 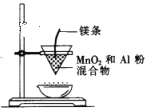 装置制取金属锰
装置制取金属锰
D. 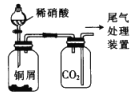 装置为制备并用排气法收集NO气体的装置
装置为制备并用排气法收集NO气体的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得
ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+2CO2↑+K2SO4+2H2O.下列说法正确的是( )
2ClO2↑+2CO2↑+K2SO4+2H2O.下列说法正确的是( )
A.H2C2O4在反应中被还原 B.1 molKClO3参加反应有2mol电子转移
C.ClO2是氧化产物 D.KClO3在反应中得到电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年2月18日,FDA批准ChelseaTherapeutics公司的Northera胶囊(屈昔多巴)用于治疗神经源性体位性低血压。下列有关该药物的说法不正确的是( )

A.微溶于水,能溶于稀盐酸,也能溶于氢氧化纳溶液
B.既能使溴水褪色,也能使酸性高锰酸钾溶液褪色
C.有手性碳原子
D.1H-NMR谱显示9种不同化学环境的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】斑蝥素具有良好的抗肿瘤活性。下列反应是一个合成斑蝥素的路线:

(1)化合物A中含氧官能团的名称为___、___。
(2)B→C的反应类型是___。
(3)D与乙二醇发生缩聚反应的方程式为:___。
(4)物质X的结构简式为___。
(5)请写出以![]() 为原料制备
为原料制备 的合成路线流程图___(无机试剂可任用,合成路线流程图见本题题干)。
的合成路线流程图___(无机试剂可任用,合成路线流程图见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学工作者研发了一种 SUNCAT的系统,借助锂循环可持续,合成其原理如图所示。下列说法不正确的是
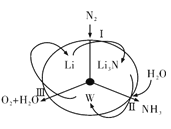
A. 过程I得到的Li3N的电子式为![]()
B. 过程Ⅱ生成W的反应为Li3N+3H2O=3LiOH+NH3↑
C. 过程Ⅲ涉及的阳极反应为4OH--4e-=O2↑+2H2O
D. 过程I、Ⅱ、Ⅲ均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是
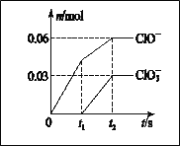
A. 苛性钾溶液中KOH的质量是4.94 g
B. 反应中转移电子的物质的量是0.09 mol
C. 氧化性ClO-<ClO3-
D. ClO3-的生成是由于温度升高引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. ![]() 固体含有离子的数目为
固体含有离子的数目为![]()
B. 常温下,![]() 的醋酸溶液中H+数目为
的醋酸溶液中H+数目为![]()
C. 13g由![]() C和
C和![]() 组成的碳单质中所含质子数一定为
组成的碳单质中所含质子数一定为![]()
D. ![]() 与足量
与足量![]() 在一定条件下化合,转移电子数为
在一定条件下化合,转移电子数为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com