
给定条件下,下列选项中所示的物质间转化均能通过一步反应实现的是( )
A. 0.1 mol • L-1 HC1 C12
C12  Ca(ClO)2(aq) B. Al3+
Ca(ClO)2(aq) B. Al3+ A1O2-
A1O2-  Al(OH)3
Al(OH)3
C. A1 NaA1O2(aq)
NaA1O2(aq)  NaAlO2(s) D. MgO(s)
NaAlO2(s) D. MgO(s)  Mg(NO3)2(aq)
Mg(NO3)2(aq)  Mg(s)
Mg(s)
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源:2016-2017学年江西省南昌市高二下学期第一次阶段性考试化学试卷(解析版) 题型:计算题
现有A、B两份混合气体,A是烯烃R与足量O2的混合气体;B是烯烃R、炔烃Q与足量O2的混合气体。取A、B各2.24L分别引燃,A充分燃烧后气体总体积仍为2.24L,B充分燃烧后气体总体积为2.34L(燃烧后的产物均为气态,其体积已换算成标准状况)。通过计算,写出:
(1)烯烃R的分子式____________________。
(2)炔烃Q的分子式____________________。
(3)求2.24L B中烯烃R所允许的最大体积是_________L。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省北校高一3月月考化学试卷(解析版) 题型:选择题
下列叙述中能肯定A金属比B金属金属性强的是( )
A. A原子的最外层电子数比B原子的最外层电子数少
B. A原子的电子层数比B原子的电子层数多
C. 1mol A从酸中置换H+生成的H2比1mol B从酸中置换H+生成的H2多
D. 常温时,A能从水中置换出氢,而B不能
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(二)化学试卷(解析版) 题型:推断题
A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子分占四个原子轨道(能级);D元素原子的已成对电子总数是未成对电子总数的3倍;E与D处于同一主族;F位于ds区,且原子的最外层只有1个电子。
(1)E+离子的电子排布式是 。
(2)B、C、D元素的第一电离能由大到小的顺序是 。
(3)B、C元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物的化学式是 ;B、C的这些氢化物的沸点相差较大的主要原因是 。
(4)A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是 ;1 mol该分子中含有π键的数目是 。
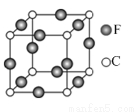
(5)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,C原子的配位数是 。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(二)化学试卷(解析版) 题型:选择题
25℃时,用0.0500 mol·L-1H2C2O4(二元弱酸)溶液滴定 25.00 mL 0.100 0 mol • L-1NaOH溶液所得滴定曲线如右图。下列说法正确的是( )
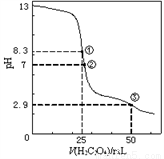
A. 点①所示溶液中:c(H+)+c(H2C2O4)+ c(HC2O4-)=c(OH-)
B. 点②所示溶液中:c(HC2O4-)+c(C2O42-)=c(Na+)
C. 点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D. 滴定过程中可能出现:c(Na+) > c(C2O42-) =c(HC2O4-)>C(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(二)化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W的原子序数依次递增,四种原子最外层电子数之和为18, X与Z同主族,Y原子的最外层电子数等于周期数,W的单质在常温下为气体。下列说法正确的是( )
A. 原子半径的大小顺序:r(Z)>r(Y)>r(X)
B. 简单氢化物的稳定性:W>Z
C. 元素X的单质只存在两种同素异形体
D. X、Y、W最高价氧化物对应的水化物两两之间能发生反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省淮北市高二下学期第一次月考化学试卷(解析版) 题型:简答题
周期表前四周期的元素a、b、c、d、e原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)e的价层电子排布式为__________。b、c、d三种元素中第一电离能最大的是_____(填元素名称);
(2)a和其他四种元素形成的二元共价化合物分子中既含有极性共价键、又含有非极性共价键的化合物是 __________(填化学式,写出两种);
(3)这五种元素的原子中有的能形成含氧酸,三角锥结构的酸是__________(填化学式);酸根是___________
(4)写出由这五种元素中的某些原子构成的,与3个c原子构成的分子互为等电子体的微粒_____(填化学式,写出两种)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省淮北市高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列离子方程式中正确的是
A.用Pt电极电解少量的CuC12溶液:2H2O+Cu2++2Cl- 通电 H2↑+C12↑+Cu(OH)2↓
B.0.01 mol/L NH4Al(SO4)2溶液与0.02 mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O
C.酸性高锰酸钾溶液中滴加H2O2溶液4MnO4- + 4H2O2 + 12H+ = 4Mn2+ + 7O2↑+ 10H2O
D.向磁性氧化铁中加入氢碘酸:Fe3O4+8H+=Fe2++2Fe3++4H2O
查看答案和解析>>
科目:高中化学 来源:四川省广安、遂宁、内江、眉山四市2017届高三第二次诊断考试理综化学试卷 题型:填空题
氯化亚铜广泛应用于有机合成。工业上以低品位铜矿(主要含CuS、Fe2O3、SiO2)为原料,
制备氯化亚铜的生产工艺如下:
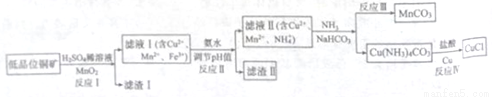
(1)CuS中Cu的化合价为_____________。
(2)滤渣Ⅰ的成分除S之外还有__________,反应Ⅰ中MnO2的作用是______________
(3)已知生成氢氧化物的pH如下表:
沉淀物 | Fe(OH)3 | Mn(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.7 | 8.3 | 4.2 |
完全沉淀的pH | 3.2 | 9.8 | 6.7 |
则反应Ⅱ中用氨水调节pH值的范围是________________。
(4)检验滤液Ⅱ中是否含有Fe3+的试剂是____________。
(5)请用化学用语回答:
①反应中Ⅲ生成难溶MnCO3的离子方程式_____________;
②反应Ⅳ素所对应的化学方程式____________________。
(6)氯化亚铜的定量分析:
步骤Ⅰ.称取0.2500g的样品和10.0mL 1.0mol/L的FeCl3溶液置于250mL锥形瓶中,不断摇动;
步骤Ⅱ.待样品溶解后,加水10.0mL和3滴指示剂;
步骤Ⅲ.用0.1000mol/L CeOSO4标准溶液滴至终点,并记录读数。重复实验两次,测得数据如下:
序号 | 1 | 2 | 3 |
起始读数 | 0.95mL | 0.70mL | 1.00mL |
终点读数 | 20.95mL | 24.95mL | 21.00mL |
已知:CuCl+FeCl3=CuCl2+FeCl2 Fe2++Ce4+=Fe3++Ce3+
①数据处理:计算CuCl纯度________________;
②误差分析:下列操作会使滴定结果偏高的是__________________。
A.锥形瓶中有少量蒸馏水
B.滴定终点读数时仰视滴定管刻度线,其他操作正确
C.0.1000mol/L CeOSO4溶液久置后浓度变小
D.滴定前滴定管尖嘴有气泡,滴定后气泡消失
E.所取FeCl3溶液体积偏大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com