
| A. | 向50mL 1mol•L-1明矾溶液中滴入少量0.1mol•L-1Ba(OH)2溶液Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ | |
| B. | 已知还原性Fe2+>Br-,a mol FeBr2溶液中通入a mol Cl2:2Fe2++2Br-+2Cl2═Br2+2Fe3++4Cl- | |
| C. | 向KI与稀硫酸的混合溶液中通入氧气:4H++O2+6I-═3I2+2H2O | |
| D. | 在澄清石灰水中加入适量碳酸氢镁溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
分析 A.KAl(SO4)2的物质的量为0.05mol,Ba(OH)2的物质的量比较少,Al3+离子过量,没有完全反应,生成硫酸钡和氢氧化铝;
B.二价铁离子还原性强于溴离子,氯气先氧化二价铁离子,剩余氯气再氧化溴离子;
C.得失电子不守恒;
D.向碳酸氢镁溶液中逐滴加入澄清石灰水,开始时氢氧根离子浓度较小,先生成Mg(OH)2沉淀;当二者物质的量相同时生成MgCO3和CaCO3;当氢氧化钙过量时生成Mg(OH)2和CaCO3.
解答 解:A.KAl(SO4)2的物质的量为0.05mol,Ba(OH)2的物质的量比较少,Al3+离子过量,没有完全反应,正确的离子方程式应为2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓,故A错误;
B.已知还原性Fe2+>Br-,a mol FeBr2溶液中通入a mol Cl2的离子反应为2Fe2++2Br-+2Cl2═Br2+2Fe3++4Cl-,故B正确;
C.向KI与稀硫酸的混合溶液中通入氧气,离子方程式为4H++O2+4I-═2I2+2H2O,故C错误;
D.当二者物质的量相同时生成MgCO3和CaCO3,反应离子方程式为Mg2++2HCO3-+Ca2++2OH-→MgCO3↓+CaCO3↓+2H2O,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质、电子和电荷守恒及反应实质,题目难度不大.


科目:高中化学 来源: 题型:填空题
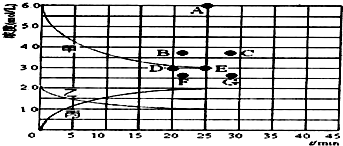 工业合成氨反应为:N2(g)+3H2(g)?2NH3(g),对其研究如下:
工业合成氨反应为:N2(g)+3H2(g)?2NH3(g),对其研究如下:| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
| n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法不正确的是( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法不正确的是( )| A. | 1mol该有机物可与2mol钠反应 | |
| B. | 该有机物可以发生酯化、加成、醇催化氧化 | |
| C. | 1mol碳酸钠可与2mol该物质反应产生1mol二氧化碳 | |
| D. | 该有机物中含有碳碳双键、羟基、羧基等官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,28 g N2所含电子数为10NA | |
| B. | 46 g钠充分燃烧时转移电子数为2NA | |
| C. | 0.1 mol•L-1NH4Cl溶液中Cl-离子数为0.1NA | |
| D. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C3H6有机物最多存在3个C-C单键,与C4H10的碳碳单键数相同 | |
| B. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双健 | |
| C. | 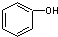 和 C7H8O分子组成相差一个-CH2-,因此是同系物关系 和 C7H8O分子组成相差一个-CH2-,因此是同系物关系 | |
| D. | 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以确定有机物结构简式为C2H5-OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)>c(SO42-),c(OH-)>c(H+) | B. | c(NH4+)=c(SO42-),c(OH-)=c(H+) | ||
| C. | c(NH4+)>c(SO42-),c(H+)>c(OH-) | D. | c(SO42-)>c(NH4+),c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
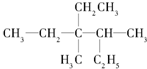 用系统命名法命名:3,4-二甲基-3-乙基己烷
用系统命名法命名:3,4-二甲基-3-乙基己烷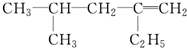
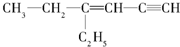 ,分子中饱和碳原子数为4,可能在同一平面上的碳原子数最多为8
,分子中饱和碳原子数为4,可能在同一平面上的碳原子数最多为8查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com