
 H++A2-(Ka2=1.0×10-2),下列说法正确的是( )
H++A2-(Ka2=1.0×10-2),下列说法正确的是( ) H++A2-(Ka2=1.0×10-2),第一步完全电离,第二步部分电离,根据平衡常数计算溶液的c(H+);
H++A2-(Ka2=1.0×10-2),第一步完全电离,第二步部分电离,根据平衡常数计算溶液的c(H+); H++A2-(Ka2=1.0×10-2),电离平衡常数较大,同浓度(0.1mol?L-1)的NaHA和Na2A溶液等体积混合,其pH应小于7;
H++A2-(Ka2=1.0×10-2),电离平衡常数较大,同浓度(0.1mol?L-1)的NaHA和Na2A溶液等体积混合,其pH应小于7; H++A2-(Ka2=1.0×10-2),可知第一步完全电离,第二步部分电离,则在0.1mol?L-1的Na2A溶液中,存在HA-和A2-离子,且c(A2-)+c(HA-)=0.1mol?L-1,又c(Na+)=0.2mol?L-1,所以c(A2-)+c(HA-)+2c(Na+)=0.5mol?L-1,故A正确;
H++A2-(Ka2=1.0×10-2),可知第一步完全电离,第二步部分电离,则在0.1mol?L-1的Na2A溶液中,存在HA-和A2-离子,且c(A2-)+c(HA-)=0.1mol?L-1,又c(Na+)=0.2mol?L-1,所以c(A2-)+c(HA-)+2c(Na+)=0.5mol?L-1,故A正确;| (0.1+x)?x |
| (0.1-x) |
| 1 |
| 100 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2010年江西省高二上学期期中考试化学卷 题型:选择题
下列叙述正确的是( )
A、物质的量浓度相等的H2S和NaHS混合溶液中:

B、相同物质的量浓度的下列溶液中:① 、②
、②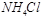 、③
、③ 、
、
④
 由大到小的顺序是:①>②>③>④
由大到小的顺序是:①>②>③>④
C、某二元酸(H2A)在水中的电离方程式是:


 则在NaHA溶液中:
则在NaHA溶液中:
D、pH=12氨水溶液与pH=2盐酸溶液等体积混合:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com