
|
根据反应:2A-+C2=2C-+A2 2C-+B2=2B-+C2 2D-+C2=2C-+D2可以推断反应物D2和B2的关系正确的是 | |
| [ ] | |
A. |
B-能被D2置换成B2 |
B. |
D-不能被B2氧化 |
C. |
氧化性:B2>D2 |
D. |
还原性:B->D- |
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 2MQ |
| m |
| 2MQ |
| m |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.如下图所示,甲、乙之间的隔板K和活塞F都可左右自由移动,甲充入2molA和1molB,乙中充入2molC和1molHe,只有A为有色气体,此时K停在O处.在一定条件下发生逆反应:2A(g)+B(g)?2C(g)△H<0;反应达到平衡后,再恢复至原温度.回答下列问题:
Ⅰ.如下图所示,甲、乙之间的隔板K和活塞F都可左右自由移动,甲充入2molA和1molB,乙中充入2molC和1molHe,只有A为有色气体,此时K停在O处.在一定条件下发生逆反应:2A(g)+B(g)?2C(g)△H<0;反应达到平衡后,再恢复至原温度.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
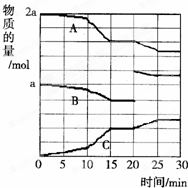 在实验室中做下列实验:把物质A、B按一定比例充入一个表面积为300cm2,容积为2L的球形容器,使压强为P,然后将整个容器用加热器加热到t℃时,发生如下反应:
在实验室中做下列实验:把物质A、B按一定比例充入一个表面积为300cm2,容积为2L的球形容器,使压强为P,然后将整个容器用加热器加热到t℃时,发生如下反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com