
【题目】常温下,向10 mL 0.2molL-1 的MOH中逐滴加入0.2 molL-1的CH3COOH溶液,溶液的导电能力如图1所示,溶液的pH 变化如图2所示(已知:常温时,NH3H2O和CH3COOH的电离常数均为1.8×10-5), 下列说法正确的是
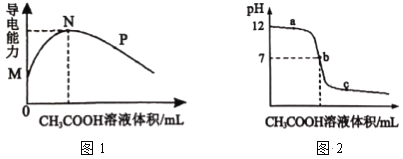
A.图l中N点时,加入CH3COOH溶液的体积为l 0 mL
B.MOH是一种弱碱,相同条件下其碱性弱于 NH3H2O 的碱性
C.图2中b点时,加入CH3COOH溶液的体积为l 0 mL
D.若c点对应醋酸的体积是15 mL,则此时溶液中:c(CH3COOH) + c(CH3COO-) < 0.1 molL-1
【答案】A
【解析】
根据图2可知,0.2molL-1 的MOH的pH=12,说明MOH为弱碱,则MOH的电离平衡常数=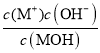 =
=![]() =5.2×10-4;向10 mL 0.2molL-1 的MOH中逐滴加入0.2 molL-1的CH3COOH溶液,随着醋酸的加入,溶液的导电能力逐渐增强,是因为反应生成了强电解质CH3COOM,当二者恰好完全反应时,溶液中CH3COOM浓度最大,溶液的导电能力最强,继续滴加醋酸溶液,溶液的体积增大,溶液的导电能力又逐渐减小,结合滴定曲线分析解答。
=5.2×10-4;向10 mL 0.2molL-1 的MOH中逐滴加入0.2 molL-1的CH3COOH溶液,随着醋酸的加入,溶液的导电能力逐渐增强,是因为反应生成了强电解质CH3COOM,当二者恰好完全反应时,溶液中CH3COOM浓度最大,溶液的导电能力最强,继续滴加醋酸溶液,溶液的体积增大,溶液的导电能力又逐渐减小,结合滴定曲线分析解答。
A.MOH为弱碱,向10 mL 0.2molL-1 的MOH中逐滴加入0.2 molL-1的CH3COOH溶液,随着醋酸的加入,溶液的导电能力逐渐增强,是因为反应生成了强电解质CH3COOM,当二者恰好完全反应时,溶液中CH3COOM浓度最大,溶液的导电能力最强,因此图l中N点时,加入CH3COOH溶液的体积为l 0 mL,故A正确;
B.根据上述计算,MOH的电离平衡常数=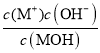 =
=![]() =5.2×10-4>1.8×10-5,即相同条件下其碱性比 NH3H2O 的碱性强,故B错误;
=5.2×10-4>1.8×10-5,即相同条件下其碱性比 NH3H2O 的碱性强,故B错误;
C.常温时,NH3H2O和CH3COOH的电离常数均为1.8×10-5,说明醋酸铵溶液显中性;MOH的碱性比 NH3H2O 的碱性强,与醋酸恰好中和时,溶液显碱性,而b点pH=7,因此b点不是滴定终点,而且b点加入CH3COOH溶液的体积大于l 0 mL,故C错误;
D.若c点对应醋酸的体积是15 mL,此时溶液中含有醋酸和CH3COOM,根据物料守恒,c(CH3COOH) + c(CH3COO-)= ![]() >0.1 molL-1,故D错误。
>0.1 molL-1,故D错误。
故选A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子在指定的溶液中,能大量共存的是( )
①酸性溶液中:Fe2+、Al3+、![]() 、Cl-、I-
、Cl-、I-
②pH=13的溶液:Na+、![]() 、
、![]() 、
、![]() 、S2-
、S2-
③水电离出来的c(H+)=10-13 mol/L的溶液:![]() 、K+、
、K+、![]() 、
、![]()
④加入铝片能放出H2的溶液:Na+、![]() 、Cu2+、
、Cu2+、![]()
⑤滴加石蕊试液显红色的溶液:Fe3+、![]() 、Cl-、
、Cl-、![]()
A.①②B.②③C.②④⑤D.②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物中,在不同条件下,既能发生水解反应和消去反应,又能发生酯化反应并能与金属钠反应放出氢气的是 ( )
①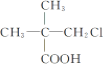 ②
②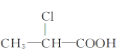 ③
③![]() ④
④
A. ②B. ②③C. ①②D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的能量变化符合如图所示关系的是

A.CaCO3![]() CaO + CO2↑
CaO + CO2↑
B.2CH3CH2OH + O2![]() 2CH3CHO+ 2H2O
2CH3CHO+ 2H2O
C.2NH4Cl+ Ba(OH)2 = BaCl2+ 2NH3 H2O
D.2Na+2H2O =2NaOH + H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当溶液中离子浓度小于1.0×10-5 molL-1 时,可视为该离子已完全除去,通过调节溶液pH的方法可以除去溶液中的某些杂质离子。常温下,某0.1 molL-1 的NiSO4溶液中含有杂质Al3+和 Fe3+,欲将这两种杂质完全除去, 需调节溶液pH 的范围可以是(不考虑溶液体积变化,已知:常温时,氢氧化镍Ksp = 1×10-16、 氢氧化铁Ksp =1×10-38、氢氧化铝Ksp = 1×10 -33)
A.2~3B.3~4
C.5 ~6D.6~8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和滴定是实验室定量测定未知酸或碱浓度的重要方法。25℃时,向 20.00 mL NaOH溶液中逐滴滴入某浓度的CH3COOH溶液以测定该醋酸溶液的浓度。滴定过程中,溶液的pH与滴入CH3COOH 溶液的体积关系如图所示, 回答下列问题:
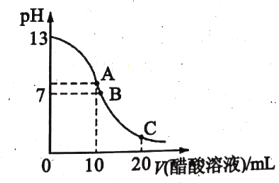
(1)滴定时,使用到的主要玻璃仪器有__________。
(2)选择的指示剂是_________,如何判断滴定达到终点 _____________。
(3)若当滴定达到终点时,测得消耗 CH3COOH 溶液的体积为 10.00 mL. 则所测醋酸溶液的浓度为 _________molL-1。
(4)图中B 点所示溶液中c(Na +)______c(CH3COO-)(填“>”“<”或“=”)。
(5)图中 C 点对应的pH=4.7,该点所示溶液中c(CH3COO-)+ c(OH-)-c(Na+)=________ molL-1(已知:lg2=0.3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.H2(g)的燃烧热△H=-285.8 kJ/mol,则2H2O(g)=2H2(g)+O2(g) △H=+571.6 kJ/mol
B.反应物的总能量低于生成物的总能量时,该反应为放热反应
C.由石墨比金刚石稳定可知:c(金刚石,s)=c(石墨,s) △H<0
D.已知:298K时,N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.0 kJ/mol。在相同温度下,向密闭容器中通入0.5 mol N2和1.5mol H2,达到平衡时放出46.0 kJ的热量
2NH3(g) △H=-92.0 kJ/mol。在相同温度下,向密闭容器中通入0.5 mol N2和1.5mol H2,达到平衡时放出46.0 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.硫酸铝溶液中加入过量氨水:Al3++4OH-=AlO![]() +2H2O
+2H2O
B.二氧化硫与酸性高锰酸钾溶液反应:5SO2+2H2O+2MnO![]() =2Mn2++5SO
=2Mn2++5SO![]() +4H+
+4H+
C.Na2S2O3溶液与稀H2SO4反应的离子方程式:S2O![]() +6H+=2S↓+3H2O
+6H+=2S↓+3H2O
D.硫酸铜溶液中加少量的铁粉:3Cu2++2Fe=2Fe3++3Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲配制100mL0.20mol·L-1的KCl溶液,实验操作如下:
A. 用托盘天平准确称取1.49gKCl固体,并放入烧杯中;
B. 加入约30mL蒸馏水,用玻璃棒搅拌使其溶解,并恢复至室温;
C .将KCl溶液由烧杯小心倒入100mL容量瓶中;
D .然后往容量瓶中加蒸馏水,直到液面接近标线1-2cm处,轻轻摇动容量瓶并静置片刻后,改用胶头滴管滴加蒸馏水;
E.使溶液凹面最低点恰好与刻度相切,把容量瓶盖好,上下翻转摇匀后装瓶。
(1)该学生操作中错误的是____________(填写字母序号)。
(2)下面哪些操作会导致所配的100mL0.20mol/L的KCl溶液浓度降低___________。
A 容量瓶用蒸馏水洗涤三次直到洗净 B 称量KCl固体时将砝码放在左盘
C 未洗涤转移KCl溶液的烧杯 D 转移KCl溶液时有KCl溶液溅出
E 定容时仰视刻度线
(3)若用0.2mol·L-1的KCl溶液配制0.05mol·L-1的KCl溶液200.0mL,需要0.20mol·L-1的KCl溶液____________mL。
(4)若在标准状况下,将V LHCl气体溶于1L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为________mol/L。(填字母)
A ![]() B
B ![]() C
C ![]()
![]() D
D ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com