
| 化学键 | Cl-Cl | Br-Br | I-I | H-Cl | H-Br | H-I | H-H |
| 键能(kJ/mol) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
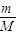 计算4g氢气的物质的量,结合H2完全燃烧生成水蒸气的热化学方程式计算氢气燃烧放出的热量.
计算4g氢气的物质的量,结合H2完全燃烧生成水蒸气的热化学方程式计算氢气燃烧放出的热量. O2(g)=H2O(g)△H=-241.8 kJ/mol,
O2(g)=H2O(g)△H=-241.8 kJ/mol,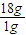 =18akJ,故生成1molH2O(l)的反应热△H=-(241.8+18a)kJ/mol,
=18akJ,故生成1molH2O(l)的反应热△H=-(241.8+18a)kJ/mol,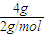 =2mol,故4g氢气完全燃烧生成水蒸气时放出的热量为2mol×241.8 kJ/mol=483.6kJ,
=2mol,故4g氢气完全燃烧生成水蒸气时放出的热量为2mol×241.8 kJ/mol=483.6kJ, O2(g)=H2O(g)△H=-241.8 kJ/mol,-(241.8+18a)kJ/mol,483.6 kJ.
O2(g)=H2O(g)△H=-241.8 kJ/mol,-(241.8+18a)kJ/mol,483.6 kJ.

科目:高中化学 来源: 题型:
| 化学键 | Cl-Cl | Br-Br | I-I | H-Cl | H-Br | H-I | H-H |
| 键能(kJ/mol) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


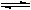 NH4++NH2-
NH4++NH2-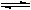 NH4++NH2-
NH4++NH2-查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | N≡N | H-H | N-H |
| 键能kJ?mol-1 | 946 | 436 | 390 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 化学键 | Cl-Cl | Br-Br | I-I | H-Cl | H-Br | H-I | H-H |
| 键能(kJ/mol) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com