
| A. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)═xCO2(g)+$\frac{y}{2}$H2O(l)△H=(-Q+23.5)kJ•mol-1 | |
| B. | CxHy(l)+( x+$\frac{y}{4}$)O2═xCO2+$\frac{y}{2}$H2O(l)△H=?-$\frac{9Q}{10}$?kJ•mol-1 | |
| C. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)═xCO2(g)+$\frac{y}{2}$H2O(l)△H=-$\frac{9Q}{10}$ kJ•mol-1 | |
| D. | CxHy(l)+( x+$\frac{y}{4}$)O2(g)═xCO2(g)+$\frac{y}{2}$H2O(l)△H=(-$\frac{10Q}{9}$+2.61)kJ•mol-1 |
分析 乙醇的燃烧热是23.5kJ/mol,1mol乙醇完全燃烧生成温度氧化物二氧化碳和液态水放出的热量,?完全燃烧1mol这种乙醇汽油生成液态水时放出的热量为Q kJ.测得该汽油中乙醇与汽油的物质的量之比为l:9.则汽油烃燃烧放热依据组成比和反应放热计算得到,依据热化学方程式书写方法写出.
解答 解:燃烧热是1mol可燃物完全燃烧生成温度氧化物放出的热量,完全燃烧1mol这种乙醇汽油生成液态水时放出的热量为Q kJ,汽油中乙醇与汽油的物质的量之比为l:9,设乙醇物质的量为x,则汽油物质的量为9x,得到10x=1mol,x=0.1mol,因此得到汽油物质的量为0.9mol,设汽油完全燃烧放热Y,反应放热关系为:0.1mol×23.5kJ/mol+0.9×Y=Q,计算得到Y=(QKJ-23.5kJ)÷0.9,1molCxHy完全燃烧生成温度氧化物放热$\frac{Q-23.5}{0.9}$KJ=(-$\frac{10Q}{9}$+2.61)kJ,反应的热化学方程式为:
CxHy(l)+(x+$\frac{y}{4}$)O2(g)═xCO2(g)+$\frac{y}{2}$H2O(l)△H=(-$\frac{10Q}{9}$+2.61)kJ•mol-1,故选D.
点评 本题考查了热化学方程式书写和计算应用,掌握基础是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
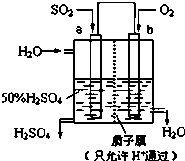
| A. | a为负极,b为正极 | |
| B. | b电极发生氧化反应 | |
| C. | H+从a极向b极移动 | |
| D. | 负极反应式为:SO2+2H2O-2e-=SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为235 | B. | 中子数为92 | C. | 电子数为143 | D. | 质量数为235 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 元素非金属性由弱到强的顺序为Z<Y<X | |
| B. | Y元素最高价氧化物对应水化物的化学式可表示为H3YO4 | |
| C. | 3种元素的气态氢化物中,Z的气态氢化物最稳定 | |
| D. | 原子半径由大到小的顺序为Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳碳双键不可旋转所以烯烃一定有顺反异构 | |
| B. | 邻二甲苯只有一种结构可以证明苯分子中无单双健的交替结构 | |
| C. | CH2Cl2无同分异构体可以证明CH4是正四面体的结构 | |
| D. | 乙烯、乙炔是平面型分子,可知CH3-CH=C(CH3)-C≡C-CH3分子中所有的碳原子共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验要求 | 实验方法 |
| 测定某工业废水的酸碱度 | |
| 检验自来水中残余氯分子 | |
| 检验CO2气体中含有的SO2 | |
| 除去FeCl2中的少量FeCl3 | |
| 除去NO中混有的少量NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成原电池时,铁作负极 | |
| B. | 形成原电池时,铜作负极 | |
| C. | 形成原电池时,电流由铁经导线流向铜 | |
| D. | 铁铆钉发生了化学腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com