
����(COCl2)�����ϡ��Ƹ��ҩ�ȹ�ҵ����������;����ҵ�ϲ��ø�����CO��Cl2�ڻ���̿���ºϳɡ�
��֪COCl2(g)  Cl2(g)��CO(g)����H����108 kJ��mol��1����Ӧ��ϵ�ﵽƽ������ʵ�Ũ���ڲ�ͬ�����µı仯״������ͼ��ʾ(��10 min��14 min��COCl2Ũ�ȱ仯����δʾ��)��
Cl2(g)��CO(g)����H����108 kJ��mol��1����Ӧ��ϵ�ﵽƽ������ʵ�Ũ���ڲ�ͬ�����µı仯״������ͼ��ʾ(��10 min��14 min��COCl2Ũ�ȱ仯����δʾ��)��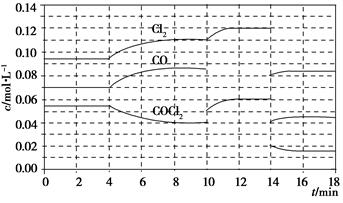
(1)��ѧƽ�ⳣ������ʽK��________�����㷴Ӧ�ڵ�8 minʱ��ƽ�ⳣ��K��________��
(2)�Ƚϵ�2 min��Ӧ�¶�T(2)���8 min��Ӧ�¶�T(8)�ĸߵͣ�T(2)________T(8)(�<������>������)��
(3)��12 minʱ��Ӧ���¶�T(8)�����´ﵽƽ�⣬���ʱc(COCl2)��________��10��12 min��CO��ƽ����Ӧ����Ϊv(CO)��________��
(4)�Ƚϲ���CO��2��3min��5��6min��12��13minʱƽ����Ӧ����(ƽ����Ӧ���ʷֱ���v(2��3)��v(5��6)��v(12��13))�Ĵ�С________________��
 ������ĩ��ϰ��ѵ��ϵ�д�
������ĩ��ϰ��ѵ��ϵ�д� С��ʿ��ĩ����100��ϵ�д�
С��ʿ��ĩ����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��һ�̶��ݻ����ܱ������У�����һ���¶ȣ���һ�������½������·�Ӧ��A(g)+2B(g)  3C(g)����֪����1molA��3molB�Ҵﵽƽ���������a molC����
3C(g)����֪����1molA��3molB�Ҵﵽƽ���������a molC����
(1)�ﵽƽ��ʱ��C�ڷ�Ӧ������е���������� (�ú���ĸa�Ĵ���ʽ��ʾ)��
(2)����ͬʵ�������£�����ͬһ�����и�Ϊ����2molA��6 mol B���ﵽƽ���C�����ʵ���Ϊ mol(�ú���ĸa�Ĵ���ʽ��ʾ)����ʱC�ڷ�Ӧ������е����������ԭƽ����� (ѡ�������С�����䡱)��
(3)����ͬʵ�������£�����ͬһ�����и�Ϊ����2 mol A��8 mol B����Ҫ��ƽ���C�ڷ�Ӧ������������������ԭƽ����ͬ����Ӧ����C mol��
(4)��ͬһ�����м�nmolA��3n molB����ƽ��ʱC�����ʵ���Ϊmmol�����ı�ʵ������������ʹC�����ʵ�����m��2m��仯����ô��n��m�Ĺ�ϵ��_____________��(����ĸn��m��ϵʽ��ʾ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��2 L�ܱ�������,800 ��ʱ��Ӧ2NO(g)+O2(g) 2NO2(g)��ϵ��,n(NO)��ʱ��ı仯���±�:
2NO2(g)��ϵ��,n(NO)��ʱ��ı仯���±�:
| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ϳɰ����������Ĵ����������˹��̵���;�����Ի�ѧ��ҵ����Ҳ�������ش�Ӱ�졣�ϳɰ���Ӧ�Ļ�ѧ����ʽΪN2(g)��3H2(g) 2NH3(g)����H����92.2 kJ��mol��1���ϳɰ���ҵ��ԭ����N2�ɴӿ����з���õ���H2���ü����̿��ˮ������Ӧ�Ƶá�
2NH3(g)����H����92.2 kJ��mol��1���ϳɰ���ҵ��ԭ����N2�ɴӿ����з���õ���H2���ü����̿��ˮ������Ӧ�Ƶá�
(1)��һ�ݻ��̶����ܱ�������ע��N2��H2�������壬����������Ӧ����ij�¶��´ﵽƽ��ʱ�������ʵ�Ũ�ȷֱ��ǣ�c(H2)��9.00 mol��L��1��c(N2)��3.00 mol��L��1��c(NH3)��4.00 mol��L��1�����¶��¸÷�Ӧ��ƽ�ⳣ��K��________��
(2)��������ͬ�����и�����1 mol N2��3 mol H2���ڲ�ͬ�����·�Ӧ���ﵽƽ�⣬�������������ʱ��仯��������ͼ��ʾ������˵������ȷ����________(����ĸ)��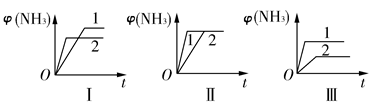
| A��ͼ������Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��p2>p1 |
| B��ͼ������Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��p1>p2 |
| C��ͼ������Dz�ͬ�¶ȶԷ�Ӧ��Ӱ�죬��T1>T2 |
| D��ͼ�������ͬ��ͬѹ�²�ͬ�����Է�Ӧ��Ӱ�죬�Ҵ�������1>2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��һ�ݻ�������ܱ������г���һ����A��B��������Ӧ��xA(g)��2B(s) yC(g)����H��0����һ�������£�������A��C�����ʵ���Ũ����ʱ��仯��������ͼ��ʾ����ش��������⣺
yC(g)����H��0����һ�������£�������A��C�����ʵ���Ũ����ʱ��仯��������ͼ��ʾ����ش��������⣺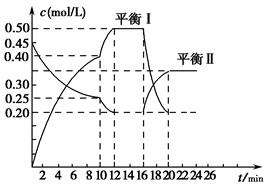
(1)��A��Ũ�ȱ仯��ʾ�÷�Ӧ0��10 min�ڵ�ƽ����Ӧ����v(A)��________��
(2)����ͼʾ��ȷ��x��y��________��
(3)0��10 min������ѹǿ________(���������䡱��С��)��
(4)�Ʋ��10 min�������߱仯�ķ�Ӧ����������________����16 min�������߱仯�ķ�Ӧ����������________��
�ټ�ѹ��������A��Ũ�ȡ�������C������������
�ݽ��¡��Ӵ���
(5)��ƽ����ƽ�ⳣ��ΪK1��ƽ����ƽ�ⳣ��ΪK2����K1________K2(�����������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ѧѧ���еĻ�ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ���������������ԭ����
��ش��������⣺ ��1����ҵ�ϲ�ȡCO��H2Ϊԭ�Ϻϳ��Ҵ����仯ѧ��Ӧ����ʽΪ��2CO��g����4H2��g��??
��1����ҵ�ϲ�ȡCO��H2Ϊԭ�Ϻϳ��Ҵ����仯ѧ��Ӧ����ʽΪ��2CO��g����4H2��g��??
CH3CH2OH��g����H2O��g������д���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK��________��
��2�������£�Ũ�Ⱦ�Ϊ0.1 mol��L��1��������Һ��pH���±���
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | Na2SO4 |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 7.0 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ijһ�ݻ�Ϊ5 L���ܱ������ڣ�����0.2 mol��CO��0.2 mol��H2O(g)���ڴ������ڵ������¸��¼��ȣ��������·�Ӧ��CO(g)��H2O(g)  CO2(g)��H2(g)����Ӧ�ų���������Ӧ��CO2��Ũ����ʱ��仯�������ͼ��ʾ��
CO2(g)��H2(g)����Ӧ�ų���������Ӧ��CO2��Ũ����ʱ��仯�������ͼ��ʾ��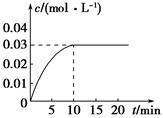
(1)����ͼ�����ݣ��ӷ�Ӧ��ʼ���ﵽƽ��ʱ��CO�Ļ�ѧ��Ӧ����Ϊ________����Ӧƽ��ʱc(H2)��________��
(2)�жϸ÷�Ӧ�ﵽƽ���������________(�����)��
��CO��С�Ļ�ѧ��Ӧ���ʺ�CO2��С�Ļ�ѧ��Ӧ�������
��CO��H2O��CO2��H2��Ũ�ȶ����
��CO��H2O��CO2��H2��Ũ�ȶ����ٷ����仯
�������淴Ӧ���ʶ�Ϊ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����£���amol N2��bmol H2�Ļ������ͨ��һ���̶��ݻ����ܱ������У��������·�Ӧ��N2��g����3H2��g��??2NH3��g����
��1������Ӧ���е�ijʱ��tʱ��nt��N2����13mol��nt��NH3����6mol����a��ֵΪ________��
��2����Ӧ�ﵽƽ��ʱ�������������Ϊ716.8 L����״���£�������NH3���������Ϊ25%������ƽ��ʱNH3�����ʵ���Ϊ_____��
��3��ԭ���������ƽ��������������ʵ���֮�ȣ�д�������������ͬ��nʼ��nƽ��________��
��4��ԭ������a��b��________��
��5���ﵽƽ��ʱ��������У�n��N2����n��H2����n��NH3����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��-��ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ��
��.SO2+2H2O+I2=H2SO4+2HI
��.2HI H2��+I2
H2��+I2
��.2H2SO4=2SO2+O2��+2H2O
(1)����������Ӧ�������ж���ȷ���� ��
a.��Ӧ�����ڳ����½���
b.��Ӧ����SO2�����Ա�HIǿ
c.ѭ���������貹��H2O
d.ѭ�������в���1 mol O2��ͬʱ����1 mol H2
(2)һ���¶��£���1 L�ܱ������м���1 mol HI(g)��������Ӧ��H2�����ʵ�����ʱ��ı仯��ͼ��ʾ��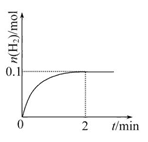
��0��2 min�ڵ�ƽ����Ӧ����v(HI)= ��
����ͬ�¶��£�����ʼ����HI(g)�����ʵ�����ԭ����2������ ��ԭ����2����
a.HI��ƽ��Ũ��
b.�ﵽƽ���ʱ��
c.ƽ��ʱH2���������
(3)ʵ������Zn��ϡ������ȡH2���������������й����Լ��е� ������H2�����ʽ�����
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com