
| ʱ��/min | 5 | 10 | 15 | 20 | 25 | 30 |
| n��Br2��/mol | 0.080 | 0.075 | 0.072 | 0.070 | 0.070 | 0.070 |
| A��20 min��Ũ�Ȳ��ٱ仯������Ϊ��Ӧ��ֹͣ |
| B��10 min��Br2��ƽ����Ӧ������0.0025 mol/��L?min�� |
| C��25 min��30 min�����У�NO�����ʵ���Ũ������ |
| D��20 minʱ��������NO��Br2�����ʵ���Ũ����� |
| ||
| ��t |
| ||
| 10 min |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2010?ɽ������һ��ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ��
��2010?ɽ������һ��ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ�� H2+I2
H2+I2 2HI��g����ƽ�ⳣ��K=
2HI��g����ƽ�ⳣ��K=�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��2011?�Ͽ���һģ����Դ������������������Դ���õ��ǵ����������Ż��⣮�������ѧ��ѧ֪ʶ�ش��������⣺
��2011?�Ͽ���һģ����Դ������������������Դ���õ��ǵ����������Ż��⣮�������ѧ��ѧ֪ʶ�ش��������⣺| �� �� | CO | H2 | CH3OH |
| Ũ��/��mol?L-1�� | 1.2 | 1.0 | 0.6 |
| c(CH3OH) |
| c(CO)c2(H2) |
| c(CH3OH) |
| c(CO)c2(H2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��һ��ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ��
��һ��ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(16��) ��ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ��
I SO2+2H2O+I2==H2SO4+2HI
II 2HI H2+I2
III 2H2SO4==2SO2+O2+2H2O
��1������������Ӧ�������ж���ȷ���� ��
a����ӦIII���ڳ����½���
b����ӦI��SO2�����Ա�HIǿ
c��ѭ���������貹��H2O
d��ѭ�������в���1molO2��ͬʱ����1 molH2
��2��һ���¶��£���1L�ܱ������м���1molHI��g����������ӦII��H2���ʵ�����ʱ��ı仯��ͼ��ʾ��0~2min�ڵ�ƽ����Ӧ����v��HI��= �����¶��£�H2��g��+I2��g��2HI��g����ƽ�ⳣ��K= ����ͬ�¶��£�����ʼ����HI��g�������ʵ�����ԭ����2������ ��ԭ����2����
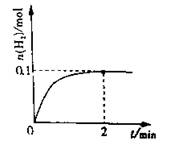
a��ƽ�ⳣ�� b��HI��ƽ��Ũ��
c���ﵽƽ���ʱ�� d��ƽ��ʱH2���������
��3��ʵ������Zn��ϡ������ȡH2����Ӧʱ��Һ��ˮ�ĵ���ƽ�� �ƶ�����������ҡ������������������������Լ��е� ������H2�����ʽ�����
a��NaNO3 b��CuSO4 c��Na2SO4 d��NaHSO3
��4����H2Ϊȼ�Ͽ���������ȼ�ϵ�ء�
��֪ 2H2��g��+O2��g��====2H2O��l�� ��H=-572kJ��mol-1
ij����ȼ�ϵ���ͷ�22.8kJ����ʱ������1molҺ̬ˮ���õ�ص�����ת����Ϊ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com