
现有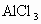 和
和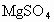 混合溶液,向其中不断加入NaOH溶液,得到的沉淀的量与加入NaOH溶液的体积如图所示,则原溶液中
混合溶液,向其中不断加入NaOH溶液,得到的沉淀的量与加入NaOH溶液的体积如图所示,则原溶液中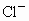 、
、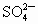 的物质的量之比为
的物质的量之比为
[ ]
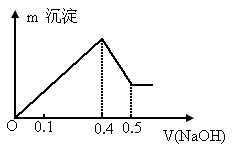
|
A.1∶1 |
B.2∶3 |
C.3∶2 |
B.6∶1 |
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) | c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
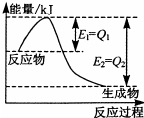 运用化学反应原理研究氮、硫、氯等单质及其化合物的反应有重要的意义.
运用化学反应原理研究氮、硫、氯等单质及其化合物的反应有重要的意义.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
(1)2Fe3++2I-====2Fe2++I2
(2)2Fe2++Br2====2Fe3++2Br-
(3)2Br-+Cl2====2Cl-+Br2
现有某混合溶液中含amolFeI2和bmolFeBr2,向该混合液中逐渐通入cmolCl2,试根据以上化学原理分析,确定当下列物质的量的离子被氧化时,通入Cl2的物质的量的取值范围:
(1)当只有I-被氧化时,c的取值范围为多少?
(2)当有Fe2+被氧化时,c的取值范围为多少?
(3)当有Br-被部分氧化时,c的取值范围是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com