
科目:高中化学 来源: 题型:
| ||
| ||
| 22400w-65V |
| 64V |
| 22400w-65V |
| 64V |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 I.小明对妈妈杀鱼时从鱼肚内取出的鳔(见图)产生了兴趣.他拟定“探究鳔内气体体积和成分”作为研究性学习的课题.小明通过查阅有关资料获知:这种鱼鳔内氧气约占四分之一其余主要为二氧化碳和氮气.探究分两步进行.
I.小明对妈妈杀鱼时从鱼肚内取出的鳔(见图)产生了兴趣.他拟定“探究鳔内气体体积和成分”作为研究性学习的课题.小明通过查阅有关资料获知:这种鱼鳔内氧气约占四分之一其余主要为二氧化碳和氮气.探究分两步进行.| 实验目的 | 实验方法 | 实验现象 |
| 验证鳔内含O2 | ||
| 验证鳔内含CO2 |

查看答案和解析>>
科目:高中化学 来源: 题型:

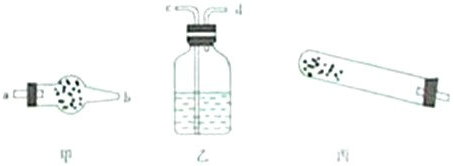
(1)甲中应盛放的试剂是_________________。
(2)乙中应盛放的试剂是_________________。
(3)首先打开活塞a,可分离出的气体是______,发生反应的化学方程式:_________________。
(4)分离出另一种气体的方法是:关闭活塞a,从漏斗丙中加入试剂_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 工业上制纯碱的方法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱(纯碱样品中Na2CO3的质量分数为92%~96%)。涉及到的化学方程式有:
工业上制纯碱的方法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱(纯碱样品中Na2CO3的质量分数为92%~96%)。涉及到的化学方程式有:
NH3+CO2+H2O → NH4HCO3,NH4HCO3+NaCl(饱和)→ NaHCO3↓+NH4Cl,![]() 。请回答:
。请回答:
(1)工业制得的纯碱中常常含有少量的氯化钠杂质,其主要原因是 。
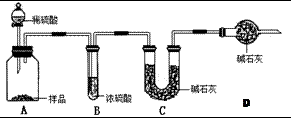
(2)现有甲、乙、丙三个学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计如下方案,请你帮助他们完成如下实验。
甲:用 (填实验仪器)称取10.0g样品,利用上图所示装置,测出反应后装置C中碱石灰增重3.52g。装置D中碱石灰的作用是 。
乙:准确称取10.00g样品后,用 (填实验仪器)配成1000mL溶液,用
式滴定管量取25.00mL放入锥形瓶中,加入2滴酚酞作指示剂,用0.15mol·L-1的标准盐酸溶液滴定至终点(有关反应为Na2CO3+HCl → NaCl+NaHCO3)。完成三次平行实验后,消耗盐酸体积的平均值为15.00mL。
丙:准确称取10.00g样品后,向其中加入过量的盐酸,充分反应直至样品中无气泡冒出,蒸干混合溶液将所得到固体物质于干燥器中冷却至室温后称量。反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g。请分析、计算后填表:
| 分析与计算 分组 | 计算样品中碳酸钠的质量分数 | 实验结果的评价 | 实验失败的主要原因及对结果的影响 |
| 甲 |
| 失 败 | |
| 乙 |
|
| |
| 丙 |
|
|
查看答案和解析>>
科目:高中化学 来源:2013-2014学年安微省池州市高三上学期第三次月考化学试卷(解析版) 题型:填空题
氢能源是一种重要的清洁能源。现有两种可产生H2的固体化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25 g/L。请回答下列问题:
(1)乙的电子式是__________。
(2)甲可在加热时将二氧化碳还原为甲烷,其化学方程式是 。
(3)乙在加热条件下与CuO反应可生成Cu和气体单质丙,写出该反应的化学方程式 。
(4)甲与乙之间能发生反应产生H2,判断理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com