
(CN)2、(OCN)2、(SCN)2等物质的性质与卤素单质相似,而CN-、OCN-、SCN-等离子的性质与卤离子相似,化学上分别将其称之为类卤素和类卤离子,不同的卤素也可以生成卤素互化物,如BrF3。下列关于(CN)2的性质的叙述中,不像卤素的是( )
A.能在空气中燃烧
B.可与银、汞、铅等生成难溶盐
C.在碱溶液中生成CN-和OCN-
D.与Cl2反应生成CNCl
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源:2014年高考化学苏教版总复习 5-1 人类对原子结构的认识练习卷(解析版) 题型:选择题
简单原子的原子结构可用下图形象地表示。其中●表示质子或电子,○表示中子,则下列有关①②③的叙述正确的组合是 ( )
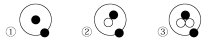
a.①②③互为同位素
b.①②③互为同素异形体
c.①②③是三种化学性质不同的粒子
d.①②③具有相同的质量数
e.①②③具有相同的质量
f.①②③是三种不同的原子
A.a、f B.b、c C.d、e D.e、f
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-1 从铝土矿到铝合金练习卷(解析版) 题型:选择题
若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,可能共存的是( )
A.NH4+ NO3- CO32- Na+
B.Na+ Ba2+ Mg2+ HCO3-
C.NO3- K+ AlO2- OH-
D.NO3- Ca2+ K+ Cl-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 2-2 钠、镁及其化合物练习卷(解析版) 题型:选择题
把500 mL NH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为( )
A.(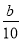 -
-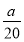 ) mol/L B.(2b-a) mol/L
) mol/L B.(2b-a) mol/L
C.(5b-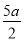 ) mol/L D.(10b-5a) mol/L
) mol/L D.(10b-5a) mol/L
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 2-1 氯、溴、碘及其化合物练习卷(解析版) 题型:填空题
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及纺织品的漂白。过氧化氢法生产亚氯酸钠的操作步骤如下:
①将氯酸钠(NaClO3)和盐酸加入到ClO2发生器中;
②将产生的ClO2气体在稳定装置中用水吸收后,再加入NaOH和双氧水;
③在固体分离装置中进行分离,得到亚氯酸钠。
已知NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O,且NaClO2在碱性条件下稳定性较高。试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在ClO2发生器中发生反应的化学方程式为 。
(2)在ClO2稳定装置中,H2O2作 (选填序号)。
A.氧化剂
B.还原剂
C.既作氧化剂又作还原剂
D.既不作氧化剂也不作还原剂
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是 (按实验先后顺序填写操作代号)。
A.过滤 B.加热 C.蒸发
D.分液 E.蒸馏 F.冷却
(4)经查阅资料可知,当pH≤2.0时,ClO2-能被I-完全还原成Cl-,欲测定成品中NaClO2的含量,现进行以下操作:
步骤Ⅰ | 称取样品Wg于锥形瓶中,并调节pH≤2.0 |
步骤Ⅱ | 向锥形瓶中加入足量的KI晶体,并加入少量的指示剂 |
步骤Ⅲ | 用c mol·L-1的Na2S2O3溶液滴定,生成I-和S4O62- |
①步骤Ⅱ中发生反应的离子方程式是 ,步骤Ⅲ中达到滴定终点时的现象是 。
②若上述滴定操作中用去了V mL Na2S2O3溶液,则样品中NaClO2的质量分数为 (用字母表示)。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 2-1 氯、溴、碘及其化合物练习卷(解析版) 题型:选择题
在氯水中存在着如下反应:Cl2+H2O=HCl+HClO,因此氯水中存在多种分子和离子。在下列实验现象中与相应离子或分子性质关系正确的是( )
A.氯水有刺激性气味说明氯水中有HCl
B.氯水中滴入品红溶液,溶液为无色说明氯水中有Cl2
C.向氯水中通入SO2气体,氯水黄绿色褪去说明Cl2发生了反应
D.向氯水中加入CaCO3有气泡产生,说明有HCl和HClO
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 13-2 化学资源与材料练习卷(解析版) 题型:填空题
现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2),现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进入有机层的过程)和反萃取(铜从有机层进入水层的过程)是现代湿法炼铜的重要工艺手段。
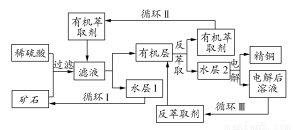
已知:①Cu+在酸性溶液中不稳定,可发生自身氧化还原反应;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;③反萃取后的水层2是硫酸铜溶液。
回答下列问题:
(1)矿石用稀硫酸处理过程中Cu2O发生反应的离子方程式为 。
(2)“循环Ⅰ”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体,该晶体的化学式是 。若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层1暴露在空气中发生反应的离子方程式 。
(3)写出电解过程中阳极(惰性电极)发生反应的电极反应式: 。
(4)“循环Ⅲ”中反萃取剂的主要成分是 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 13-1 化学与工农业生产练习卷(解析版) 题型:填空题
工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%):
压强/MPa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
400 | 99.2 | 99.6 | 99.7 | 99.9 |
500 | 93.5 | 96.9 | 97.8 | 99.3 |
600 | 73.7 | 85.8 | 89.5 | 96.4 |
(1)已知SO2的氧化是放热反应,如何利用表中数据推断此结论?________________________________________________________。
(2)在400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:__________________________________________。
(3)选择适宜的催化剂,是否可以提高SO2的转化率?________(填“是”或“否”),是否可以增大该反应放出的热量?________(填“是”或“否”)。
(4)为提高SO3吸收率,实际生产中用________吸收SO2。
(5)已知:2SO2(g)+O2(g)=2SO3(g) ΔH=-196.9 kJ·mol-1,计算每生产1万吨98%的硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 12-2 微粒间作用力与物质性质练习卷(解析版) 题型:选择题
现有四种晶体的晶胞,其离子排列方式如图所示,其中化学式不属AB型的是( )
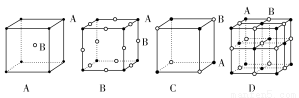
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com