
常温下按照如下方案完成实验。
|
实验编号 |
反应物 |
催化剂 |
|
① |
10mL2% H2O2溶液 |
无 |
|
② |
10mL5% H2O2溶液 |
无 |
|
③ |
10mL5% H2O2溶液 |
1mL0.1mol·L-1FeCl3溶液 |
|
④ |
10mL5% H2O2溶液+少量HCl溶液 |
1mL0.1mol·L-1FeCl3溶液 |
|
⑤ |
10mL5% H2O2溶液+少量NaOH溶液 |
1mL0.1mol·L-1FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是_____________________________________。
(2)实验①和②的目的是____________________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是____________________。
(3)写出实验③的化学反应方程式 。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。
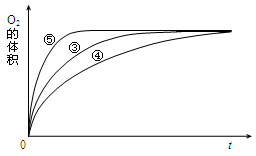
分析上图能够得出的实验结论是______________________________________。
(1)降低了活化能(2分)
(2)探究浓度对反应速率的影响(2分);向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中)(2分)
(3)2H2O2 O2↑+2H2O (2分)
O2↑+2H2O (2分)
(4)碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率 (2分)
【解析】
试题分析:(1)催化剂改变反应的途径,降低反应所需的活化能,从而加快反应速率。
(2)实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响;为了便于比较,应在相同的条件下利用一个变量来比较,则向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中)。
(3)双氧水再催化剂的作用下分解生成氧气和水,反应的化学方程式为2H2O2 O2↑+2H2O。
O2↑+2H2O。
(4)由图可知,⑤的反应速率最大,④的反应速率最小,但最终生成的气体体积相同。根据表中数据可知,方案⑤中添加了氢氧化钠溶液,④中加入了盐酸,这说明碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率。
考点:考查外界条件对反应速率的影响以及实验方案设计与评价等


科目:高中化学 来源: 题型:阅读理解
 某化学兴趣小组的学生从网上查得如下信息:①钠能在CO2中燃烧.②常温下CO能与PdCl2溶液反应得到黑色的Pd.经过分析讨论,他们认为钠在CO2中燃烧时,还原产物可能是碳,也可能是CO,氧化产物可能是Na2CO3.为验证上述推断,他们设计如下方案进行实验,请回答下列问题.
某化学兴趣小组的学生从网上查得如下信息:①钠能在CO2中燃烧.②常温下CO能与PdCl2溶液反应得到黑色的Pd.经过分析讨论,他们认为钠在CO2中燃烧时,还原产物可能是碳,也可能是CO,氧化产物可能是Na2CO3.为验证上述推断,他们设计如下方案进行实验,请回答下列问题.查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省高三上学期第一次月考化学试卷(解析版) 题型:实验题
某化学兴趣小组的学生从网上查得如下信息:①钠能在CO2中燃烧。②常温下CO能与PdCl2溶液反应得到黑色的Pd。经过分析讨论,他们认为钠在CO2中燃烧时,还原产物可能是碳,也可能是CO,氧化产物可能是Na2CO3。为验证上述推断,他们设计如下方案进行实验,请回答下列问题。


(1)他们欲用上述装置组装一套新装置:用石灰石与盐酸反应制取CO2(能随意控制反应的进行)来证明钠能在CO2中燃烧并检验其还原产物,所用装置接口连接顺序为_________。
(2)若装置D的PdCl2溶液中有黑色沉淀,C中有残留固体(只有一种物质),则C中反应的化学方程式为________________________________________________________;
若装置D的PdCl2溶液中无黑色沉淀,C中有残留固体(有两种物质),则C中反应的化学方程式为___________________________________________________________。
(3)后来有一位同学提出,钠的氧化产物也可能是Na2O,因此要最终确定钠的氧化产物是何种物质,还需要检验C中残留的固体是否含有Na2O,为此,他认为应较长时间通入CO2以确保钠反应完,然后按照如下方案进行实验,可确定残留固体中是否含有Na2O,他的实验方案是_________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com