
 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示.请认真观察如图,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示.请认真观察如图,然后回答问题.分析 (1)从图上分析,反应物能量高于生成物,反应放热;反应热等于生成物与反应物的能量差;
(2)图象分析虚线是降低反应的活化能,单位体积内活化分子数增多反应速率加快,改变的条件是加入了催化剂;
(3)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
(4)①碳酸钙分解反应诶吸热反应,焓变大于0;
②强酸强碱完全反应生成1molH2O放出的热量为中和热;
③碳完全燃烧生成稳定氧化物放出热量为燃烧热;
④一氧化碳完全燃烧生成稳定氧化物放出热量为燃烧热;
⑤强酸强碱完全反应生成1molH2O放出的热量为中和热;
(5)依据热化学方程式和盖斯定律计算得到.
解答 解:(1)图示反应是放热反应,反应热等于生成物与反应物的能量差,即E2-E1,
故答案为:放热;E2-E1;
(2)图象分析可知,虚线表示的是降低反应的活化能,单位体积内活化分子数增多反应速率加快,但达到平衡状态相同,化学平衡不变化,改变的条件是加入了催化剂,
故答案为:降低;加快;使用催化剂;
(3)在反应N2+3H2?2NH3中,断裂3molH-H键,1mol N≡N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,即N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1;
(4)①碳酸钙分解反应为吸热反应,焓变大于0,故①错误;
②强酸强碱完全反应生成1molH2O放出的热量为中和热,溶液标注错误,应为aq,所以不是中和热的热化学方程式,故②错误;
③碳完全燃烧生成稳定氧化物放出热量为燃烧热,热化学方程式为碳的燃烧热热化学方程式;
④一氧化碳完全燃烧生成稳定氧化物放出热量为燃烧热,热化学方程式为碳的燃烧热热化学方程式;
⑤强酸强碱完全反应生成1molH2O放出的热量为中和热,选项为中和热的热化学方程式;
故答案为:①②;③④;⑤;
(5)①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ•mol-1
由盖斯定律②+③+①×2得到3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H=-246.4 kJ•mol-1,
故答案为:-246.4kJ•mol-1.
点评 本题考查了化学反应能量变化分析,活化能概念的理解应用,同时还考查了反应热的计算,注意把握从键能的角度计算反应热的方法,本题还考查了热化学方程式书写方法,燃烧热、中和热概念的分析判断,盖斯定律的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 煤燃烧是热能转化为化学能的过程 | |
| B. | 动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 | |
| C. | 植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程 | |
| D. | 化石燃料属于一次能源,电能属于二次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
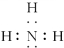
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
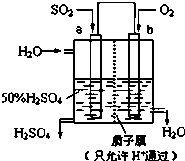
| A. | a为负极,b为正极 | |
| B. | b电极发生氧化反应 | |
| C. | H+从a极向b极移动 | |
| D. | 负极反应式为:SO2+2H2O-2e-=SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是电解CuCl2溶液的装置,其中c、d为石墨电极,请填写下列空格:
如图是电解CuCl2溶液的装置,其中c、d为石墨电极,请填写下列空格: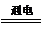 Cu+Cl2↑.
Cu+Cl2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
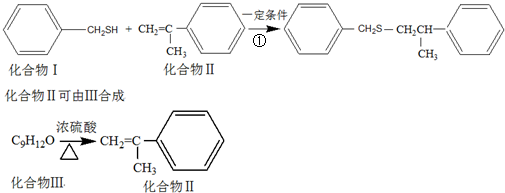
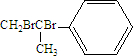 .
. .
.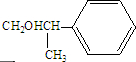 .化合物Ⅳ与新制Cu(OH)2反应的化学方程式
.化合物Ⅳ与新制Cu(OH)2反应的化学方程式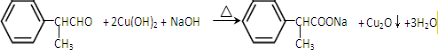 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com