
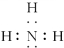
分析 ①第三周期中,有两个成单电子,外围电子排布为3s23p2或3s23p4;
②四核10电子粒子中含4个原子、电子数为10;
③第四周期元素中,4p轨道半充满说明4p轨道中含有3个电子,3d轨道半充满说明3d轨道中含有5个电子;
解答 解:①第三周期中,有两个成单电子,外围电子排布为3s23p2或3s23p4,所以为Si、S,
故答案为:Si、S;
②四核10电子粒子中含4个原子、电子数为10,符合条件的有NH3、H3O+,氨气的电子式为: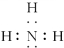 ,
,
故答案为: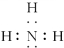 ;
;
③3d轨道半充满说明3d轨道中含有5个电子,根据电子排布规则知,该原子的4s能级上电子全满或半充满,所以该基态原子的核外电子排布式为:[Ar]3d54s1或[Ar]3d54s2,所以为Cr和Mn,
故答案为:Cr、Mn;
点评 本题考查原子结构与性质,为高频考点,把握短周期元素的性质、原子结构为解答的关键,注重基础知识的考查,题目难度不大.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:HX>H2Y>ZH3 | B. | 非金属活泼性:Y<X<Z | ||
| C. | 单质的氧化性:X2>Y>Z | D. | 原子最外电子层上电子数不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③⑥ | C. | ②④⑥ | D. | ①②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 | |
| B. | 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 | |
| C. | 由氯代环己烷制环己烯;由丙烯制1,2-二溴丙烷 | |
| D. | 由乙烯制聚乙烯;由1,3-丁二烯合成顺丁橡胶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示.请认真观察如图,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示.请认真观察如图,然后回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 容器中SO2、O2、SO3共存 | |
| B. | SO2与SO3的浓度保持不变 | |
| C. | 容器中SO2、O2、SO3的物质的量之比为2:1:2 | |
| D. | 反应容器中压强不随时间变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com