
【题目】水煤气变换反应是重要的化工过程,反应方程式为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH。我国科学家在这一变换中利用双功能催化剂突破了低温下高转化率与高反应速率不能兼得的难题。反应历程如图所示:

下列说法错误的是( )
A.该反应ΔH<0
B.根据历程图示过程Ⅰ为吸热过程、过程Ⅲ为放热过程
C.整个历程中两个H2O分子都参与了反应
D.使用双功能催化剂降低了水煤气变换反应的ΔH
科目:高中化学 来源: 题型:
【题目】以下6种说法中正确的数目是
![]() 在硝酸蒸气的氛围中蒸干
在硝酸蒸气的氛围中蒸干![]() 溶液会得到
溶液会得到![]() 固体
固体
![]() 溶解度和
溶解度和![]() 一样只与温度有关
一样只与温度有关
![]() 使用精密pH试纸测出84消毒液的pH为
使用精密pH试纸测出84消毒液的pH为![]()
![]() 升温对于强酸、强碱pH不发生变化,弱酸升温pH变小
升温对于强酸、强碱pH不发生变化,弱酸升温pH变小
![]() 滴定氨水用甲基橙做指示剂效果更好
滴定氨水用甲基橙做指示剂效果更好
![]() 实验室制氢气,为加快氢气的生成速率,可向稀硫酸中滴加少量
实验室制氢气,为加快氢气的生成速率,可向稀硫酸中滴加少量![]() 溶液.
溶液.
A.1B.2C.3D.全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一体积不变的密闭容器中充入![]() 和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化的关系如图1所示,其中
和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化的关系如图1所示,其中![]() 阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且
阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且![]() 各改变一种不同的条件。
各改变一种不同的条件。

(1)![]() 时改变的条件为___________,B的起始物质的量为____________。
时改变的条件为___________,B的起始物质的量为____________。
(2)各阶段平衡时对应的平衡常数如下表所示:
|
|
|
|
|
|
|
|
则![]() 之间的关系为___________。(用“>”、“<”或“=”)。
之间的关系为___________。(用“>”、“<”或“=”)。
(3)![]() 阶段,若A的物质的量变化了0.01 mol,而此阶段中反应体系的能量变化为akJ(a>0),写出此条件下该反应的热化学方程式:______________________。
阶段,若A的物质的量变化了0.01 mol,而此阶段中反应体系的能量变化为akJ(a>0),写出此条件下该反应的热化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,能达到相应实验目的的是
A.方案①用于分离I2和NH4I固体
B.方案②用于比较CuSO4和MnO2的催化活性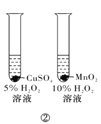
C.方案③用于测定中和热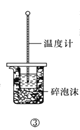
D.方案④用于比较醋酸和硼酸的酸性强弱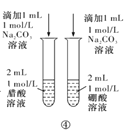
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C △H <0,分两步进行 ① A+B→X △H>0 ② X→C △H<0 。下列示意图中,能正确表示总反应过程中能量变化的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式能用来解释相应实验现象的是( )
实验现象 | 离子方程式 | |
A | 向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 |
|
B | 向沸水中滴加饱和氯化铁溶液得到红褐色液体 |
|
C | 二氧化硫使酸性高锰酸钾溶液褪色 |
|
D | 氧化亚铁溶于稀硝酸 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气因含有少量H2S等气体开采应用受限。T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是
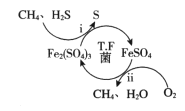
A. 该脱硫过程需要不断添加Fe2(SO4)3溶液
B. 脱硫过程O2间接氧化H2S
C. 亚铁是血红蛋白重要组成成分,FeSO4可用于治疗缺铁性贫血
D. 《华阳国志》记载“取井火煮之,一斛水得五斗盐”,我国古代已利用天然气煮盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Ba2+、Fe3+、Na+、K+、NH4+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1mol/L.往该溶液中加入BaCl2和过量的盐酸,无白色沉淀生成。另取少量原溶液,设计并完成如下实验。下列判断正确的是( )
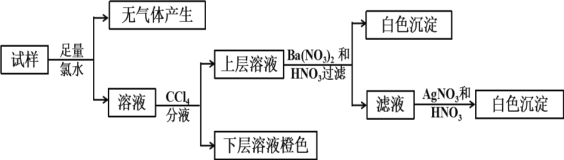
A.Ba2+、Fe3+、SO42-、CO32-肯定不存在,Na+、K+肯定存在
B.原溶液肯定不含SO42-和SO32-
C.若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,对溶液中离子的判断有影响
D.是否含NH4+需另做实验判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,含少量碳及二氧化硅)为原料制备的流程如下:
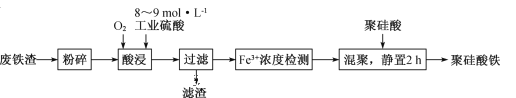
(1)废铁渣进行“粉碎”的目的是______________________。
(2)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等,其中酸浸温度对铁浸取率的影响如图所示。
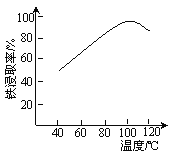
①加热条件下酸浸时,Fe3O4与硫酸反应的化学方程式为_____________。
②酸浸时,通入O2的目的是__________。
③当酸浸温度超过100 ℃时,铁浸取率反而减小,其原因是____________。
(3)滤渣的主要成分为____________(填化学式)。
(4)“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com